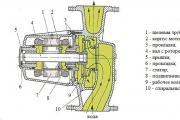
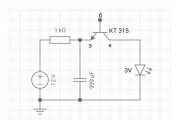
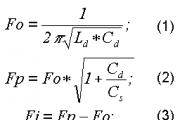Ядовитый углекислый газ. Осторожно! Углекислый газ! Содержание со2 в воздухе
О проблеме превышения содержания углекислого газа в воздухе помещений говорят все чаще в последние 20 лет. Выходят новые исследования и публикуются новые данные. Поспевают ли за ними строительные нормы для зданий, в которых мы живем и работаем?
Самочувствие и работоспособность человека тесно связаны с качеством воздуха там, где он трудится и отдыхает. А качество воздуха можно определить по концентрации углекислого газа СО2.
Почему именно СО2?
- Этот газ есть везде, где есть люди.
- Концентрация углекислого газа в помещении напрямую зависит от процессов жизнедеятельности человека – ведь мы его выдыхаем.
- Превышение уровня углекислого газа вредно для состояния организма человека, поэтому за ним необходимо следить.
- Рост концентрации СО2 однозначно свидетельствует о проблемах с вентиляцией.
- Чем хуже вентиляция, тем больше загрязнителей концентрируется в воздухе. Поэтому рост содержания углекислого газа в помещении – признак того, что качество воздуха снижается.
В последние годы в профессиональных сообществах врачей и проектировщиков зданий появляются предложения пересмотреть методику определения качества воздуха и расширить перечень измеряемых веществ. Но пока ничего нагляднее изменения уровня CO2 не нашли.
Как узнать, является ли приемлемым уровень углекислого газа в помещении? Специалисты предлагают перечни нормативов, причем для зданий разных назначений они будут различными.
Нормы углекислого газа в жилых помещениях
Проектировщики многоквартирных и частных домов берут за основу ГОСТ 30494-2011 под названием «Здания жилые и общественные. Параметры микроклимата в помещениях». Этот документ оптимальным для здоровья человека уровнем CO2 считает 800 — 1 000 ppm. Отметка на уровне 1 400 ppm – предел допустимого содержания углекислого газа в помещении. Если его больше, то качество воздуха считается низким.
Однако уже 1 000 ppm не признается вариантом нормы целым рядом исследований, посвященных зависимости состояния организма от уровня CO2. Их данные свидетельствует о том, что на отметке 1 000 ppm больше половины испытуемых ощущают ухудшения микроклимата: учащение пульса, головную боль, усталость и, конечно, пресловутое «нечем дышать».
Физиологи нормальным уровнем CO2 считают 600 – 800 ppm.
Хотя некоторые единичные жалобы на духоту возможны и при указанной концентрации.
Выходит, что строительные нормативы уровня СО2 вступают в противоречие с выводами исследователей-физиологов. В последние годы именно со стороны последних все громче раздаются призывы обновить допустимые пределы, но пока дальше призывов дело не идет. Чем ниже норма СО2, на которую ориентируются строители, тем дешевле обходится . А расплачиваться за это приходится тем, кто вынужден решать проблему вентилирования квартиры самостоятельно.
Нормы углекислого газа в школах
Чем больше углекислого газа в воздухе, тем сложнее сосредоточиться и справиться с учебной нагрузкой. Зная об этом, власти США рекомендуют школам поддерживать уровень СО2 не выше 600 ppm. В России отметка чуть выше: уже упомянутый ГОСТ считает оптимальным для детских учреждений 800 ppm и менее. Однако на практике не только американский, но и российский рекомендуемый уровень – голубая мечта для большинства школ.
Один из наших показал: больше половины учебного времени количество углекислого газа в воздухе превышает 1 500 ppm, а иногда приближается к 2 500 ppm! В таких условиях невозможно сосредоточиться, способность к восприятию информации критически снижается. Другие вероятные симптомы переизбытка СО2: гипервентиляция, потливость, воспаление глаз, заложенность носа, затрудненное дыхание.
Почему так происходит? Кабинеты редко проветриваются, потому что открытое окно – это простывшие дети и шум с улицы. Даже если школьное здание оснащено мощной центральной вентиляцией, она, как правило, либо шумная, либо устаревшая. Зато окна в большинстве школ современные – пластиковые, герметичные, не пропускающие воздух. При численности класса 25 человек в кабинете площадью 50–60 м2 c закрытым окном углекислый газ в воздухе подскакивает на 800 ppm за каких-то полчаса.
Нормы углекислого газа в офисах
В офисах наблюдаются те же проблемы, что и в школах: повышенная концентрация СО2 мешает сосредоточиться. Ошибки множатся, и производительность труда падает.
Нормативы содержания углекислого газа в воздухе для офисов в целом те же, что для квартир и домов: приемлемым считается 800 – 1 400 ppm. Однако, как мы уже выяснили, уже 1 000 ppm доставляет дискомфорт каждому второму.
К сожалению, во многих офисах проблема никак не решается. Где-то просто ничего о ней не знают, где-то ее сознательно игнорирует руководство, а где-то – пытается решить при помощи кондиционера. Струя прохладного воздуха действительно создает кратковременную иллюзию комфорта, однако углекислый газ никуда не исчезает и продолжает делать свое «черное дело».

Может быть и так, что офисное помещение построено с соблюдением всех нормативов, но эксплуатируется с нарушениями. Например, плотность размещения сотрудников слишком велика. Согласно строительным правилам, на одного человека должно приходиться от 4 до 6,5 м2 площади. Если сотрудников больше, то и углекислый газ в воздухе накапливается быстрее.
Выводы и выходы
Проблема с вентиляцией наиболее остро стоит в квартирах, офисных зданиях и детских учреждениях.
Тому есть две причины:
1. Расхождение между строительными нормативами и санитарно-гигиеническими рекомендациями.
Первые гласят: не выше 1 400 ppm CO2, вторые предупреждают: это слишком много.
| Концентрация CO2 (ppm) | Строительные нормативы (согласно ГОСТ 30494-2011) | Влияние на организм (согласно санитарно-гигиеническим исследованиям) |
|---|---|---|
| менее 800 | Воздух высокого качества | Идеальное самочувствие и бодрость |
| 800 – 1 000 | Воздух среднего качества | На уровне 1 000 ppm каждый второй ощущает духоту, вялость, снижение концентрации, головную боль |
| 1 000 - 1 400 | Нижняя граница допустимой нормы | Вялость, проблемы с внимательностью и обработкой информации, тяжелое дыхание, проблемы с носоглоткой |
| Выше 1 400 | Воздух низкого качества | Сильная усталость, безынициативность, неспособность сосредоточиться, сухость слизистых, проблемы со сном |
2. Несоблюдение нормативов при возведении, реконструкции или эксплуатации здания.
Самый простой пример – установка пластиковых окон, которые не пропускают уличный воздух и усугубляют тем самым ситуацию с накоплением углекислого газа в помещении.
Описание:
Еще несколько лет назад в отечественных нормативных документах при проектировании вентиляции в помещениях с пребыванием людей СО2 учитывался только косвенно в удельных нормах воздухообмена. В зарубежных стандартах его концентрация в воздухе помещений служит индикатором содержания других более вредных загрязняющих веществ и соответствующей интенсивности вентиляции.
К вопросу о нормировании воздухообмена по содержанию CO 2 в наружном и внутреннем воздухе
И. М. Квашнин , канд. тех. наук, ведущий специалист НПП «Энергомеханика»
И. И. Гурин , директор компании Alfaintek Oy
В журнале «АВОК», № 4, 2008, была опубликована статья Ю. Д. Губернского и Е. О. Шилькрота «Сколько воздуха нужно человеку для комфорта? », которая вызвала большой интерес у специалистов. Представленный в статье материал показывает, что хотя проблеме нормирования воздухообмена по СО 2 уделяется много внимания, материала для решения этого вопроса пока не достаточно. Данная статья предлагает продолжить обсуждение этой проблеммы.
Еще несколько лет назад в отечественных нормативных документах при проектировании вентиляции в помещениях с пребыванием людей СО 2 учитывался только косвенно в удельных нормах воздухообмена. В зарубежных стандартах его концентрация в воздухе помещений служит индикатором содержания других более вредных загрязняющих веществ и соответствующей интенсивности вентиляции. Высокие концентрации углекислого и других газов в наружном воздухе больших городов приводят к необходимости выбора: либо интенсифицировать воздухообмен, вызывая цепную реакцию увеличения потребления энергоресурсов путем сжигания органического топлива с дополнительным загрязнением атмосферы (в том числе СО 2), либо производить очистку приточного воздуха от газов. Это соответствует последним исследованиям ученых о вреде двуокиси углерода для здоровья людей при повышении концентрации в два–три раза по сравнению с чистым атмосферным воздухом.
По данным современной медицины, в составе метаболических (жизнедеятельностных) выделений организма человека выявлено несколько сотен химических соединений, из которых более двухсот веществ – с поверхности кожи и свыше ста – с выдыхаемым воздухом. Одним из наиболее интересных веществ является углекислый газ. Это относительно безвредный газ по ГОСТ 12.1.007-76 относится к 4 классу опасности, он содержится в небольших количествах в составе чистого атмосферного воздуха. По данным большинства источников, его концентрация составляет примерно 0,03 % от объема (об.), то есть в 1 м 3 содержится 0,3 л, или 0,3/22,4 = 0,01339 моль (по данным БСЭ – 0,0314 % об.). Зная молекулярную массу диоксида азота 44 г/моль, легко определить его массу в 1 м 3 , а именно: 44 х 0,01339 = 0,589 г. Концентрация, соответственно, равна 589 мг/м 3 . В таких количествах углекислый газ необходим для жизнедеятельности человека. По ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия» плотность газообразной двуокиси углерода составляет 1,839 кг/м 3 , то есть примерно в 1,5 раза больше воздуха. В таблице 1 приведены формулы перевода величин из одних единиц в другие. Как в отечественных нормативных документах, так и в зарубежных отсутствует норматив предельно допустимой концентрации углекислого газа в атмосферном воздухе. Очевидно, что содержание в воздухе СО 2 будет различным в сельской местности, небольших и крупных городах. Фоновые концентрации определяются выбросами автотранспорта, сжиганием топлива на предприятиях теплоэнергетики и работой промышленных предприятий. Затруднение заключается в том, что мониторинг за уровнем СО 2 службами Центра по гидрометеорологии не ведется. За рубежом углекислый газ, наряду с окислами азота, оксидом углерода, диоксидом серы и летучими органическими соединениями, является типичным загрязняющим веществом, которое подлежит учету при оценке наружного воздуха для проектирования систем вентиляции и кондиционирования. Европейский стандарт ЕН 13779 «Ventilation for non-residential buildings – Performance requirements for ventilation and room-conditioning systems» в качестве общего базового руководства предлагает принимать концентрацию углекислого газа в сельской местности 350 ppm, в небольших городах 400 ppm, в центрах городов 450 ppm. На самом деле она может быть существенно выше. Например, измерения в центре Москвы в безветренную погоду в конце лета в районе Садового кольца показали, что при достаточно интенсивном движении транспорта уровень СО 2 поднимался до 900 ppm (0,09 % об.). Погуляв несколько часов эту концентрацию и без приборов ощутит на себе каждый в виде головной боли.
Примечание:
С а – числовое значение концентрации в заданных единицах;
С х – числовое значение концентрации в искомых единицах;
М – молекулярная масса газа;
Р – общее давление газовой смеси, Па;
Т – температура, °К.
Одним из способов, широко применяемых на Западе, для определения требуемой интенсивности воздухообмена в общественных зданиях, является использование углекислого газа в качестве индикатора качества воздуха. По его концентрации судят о содержании других веществ, выделяемых человеком, которых в относительных концентрациях (отношение фактической концентрации к ПДК) образуется меньше. При снижении уровня СО 2 разбавлением приточным воздухом одновременно снижается уровень концентрации других веществ. Углекислый газ выбран из-за того, что его концентрацию легко измерить с достаточно высокой точностью и его массовое выделение значительно больше других вредных веществ.
Общеизвестно, что один человек в спокойном состоянии, например работник офиса, за один час потребляет 20–30 л кислорода с выделением 18–25 л углекислого газа, а при занятиях в фитнес- и тренажерных залах – до 36 л и более. Если во вдыхаемом воздухе содержится 0,03 % (об.) СО 2 , то в выдыхаемом – 3,6 % (об.), то есть возрастает более чем в 100 раз. Интенсивно выделяется углекислый газ от газовой плиты при приготовлении пищи. При возрастании содержания в воздухе значения CO2 выше определенной величины человек начинает чувствовать себя дискомфортно, может впадать в дремотное состояние, возникают головные боли, тошнота, чувство удушья. Его влияние настолько постепенное и слабое, что его трудно сразу обнаружить. Этот предел индивидуален для различных людей – мужчин и женщин, детей. Однако до недавнего времени в отечественных документах отсутствовал норматив качества воздуха помещений для углекислого газа. Лишь гигиеническими нормативами в 2006 году введена максимально разовая ПДК равная 13 790 ppm (27 000 мг/м 3) и среднесменная 4 597 ppm (9 000 мг/м 3) для воздуха рабочей зоны производственных помещений. Для сравнения: в США эти цифры составляют 30 000 ppm (58 740 мг/м 3) и 5 000 ppm (9 790 мг/м 3), соответственно. В шахтах на рабочих местах допускается концентрация 0,5 % (об.) или 5 000 ppm. В соответствии с ГОСТ 8050-85 «При концентрациях более 5 % двуокись углерода оказывает вредное влияние на здоровье человека… При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья». Напомним, что максимально разовая и среднесменная концентрация ПДК воздуха рабочей зоны определяются ГОСТ 12.1.005-88 и гигиеническими нормативами ГН 2.2.5.1313-03, ГН 2.2.5.1314-03.
Для помещений жилых и общественных зданий этот норматив по-прежнему отсутствует. Коллизия возникает в связи с тем, что в соответствии со СНиП 41-01-2003 «Отопление, вентиляция и кондиционирование» , СанПиН 2.1.2.1002-00 «Санитарно-эпидемиологические требования к жилым зданиям и помещениям» и др. для этих помещений норматив качества принимается равным для воздуха населенных мест (ГН 2.1.6.1338-03; ГН 2.1.6.1339-03), который, как отмечалось выше, отсутствует. Однако, в отличие от многих других загрязняющих веществ, практически не выделяющихся в помещениях, содержание двуокиси углерода интенсивно увеличивается. Интересно, что еще в справочнике Р. В. Щекина 1976 года приводится расчет требуемого воздухообмена на разбавление СО 2 одним человеком.
Европейский стандарт 2004 года предлагает разделять воздух в помещениях с пребыванием людей на категории качества от IDA 4 – низкое, IDA 2 и 3 – среднее, до IDA 1 – высокое. Предполагается несколько способов определения категории качества. Один из них оценивает превышение уровня СО 2 , как индикатора, в воздухе помещений над наружным воздухом (табл. 2).
| Таблица 2 | |||||||||||||||||
|
|||||||||||||||||
Зная местонахождение здания (сельская местность, город) и уровень концентрации СО 2 в наружном воздухе легко определить его расчетное содержание в воздухе помещения. Далее приводятся рекомендации по установке определенных классов фильтров, как правило, не менее двух ступеней, для достижения необходимой чистоты воздуха в соответствии с требуемой категорией качества IDA. Это касается не только твердых пылевых частиц, но и основных газов: NO x , SO 2 , полициклических ароматических углеводородов и летучих органических соединений. Стандарт гласит: «В городской среде рекомендуется использование молекулярных (газовых) фильтров». Отметим, что по представлению ассоциации АСИНКОМ европейский стандарт принят без изменений как отечественный ГОСТ Р ЕН 13779-2007 «Вентиляция в нежилых зданиях. Технические требования к вентиляции и кондиционированию». ФГУП СТАНДАРТИНФОРМ объявило о том, что он вводится в действие с 1 октября 2008 года.
Допустимое приемлемое значение содержания углекислого газа в помещениях с пребыванием людей было установлено гигиенистами и принято, например, стандартом ASHRAE 62-1989 на уровне 1 000 ppm (1 958 мг/м 3) или 0,1 % (об.). На эту величину опираются многие авторы при расчетах воздухообмена. Это значение фигурирует в СП 2.5.1198-03 «Санитарные правила по организации пассажирских перевозок» для железнодорожных вокзалов и СанПиН 2.5.1.051-96 «Условия труда и отдыха для летного состава гражданской авиации» для кабин воздушных судов. Зная выделение СО 2 одним человеком в офисе – 18 л/ч (0,005 л/с) или 35 200 мг/ч по формуле (Л.2) СНиП 41-01-2003 требуемый расход приточного воздуха для одного человека равен
L = 35 200 / (1 958 – 589) = 25,7 м 3 /ч.
В единицах л/с и ppm L = х 106 = 7,14 л/с.
Первым отечественным документом, в котором предпринята попытка регламентировать содержание СО 2 в наружном и внутреннем воздухе, является стандарт АВОК «Здания жилые и общественные. Нормы воздухообмена» . В качестве рекомендуемой справочной предлагается предельно допустимая концентрация в наружном воздухе: сельская местность – 332 ppm (650 мг/м 3), малые города – 409 ppm (800 мг/м 3), большие города – 511 ppm (1 000 мг/м 3). Верхний допустимый предел концентрации СО 2 в помещениях жилых и общественных зданий не должен превышать концентрацию в наружном воздухе на 638 ppm (1 250 мг/м 3). В этом случае требуемый воздухообмен на 1 человека составит 28 м 3 /ч.
В результате последних исследований, проведенных индийскими учеными в городе Калькутта , было выяснено, что так же, как NO 2 , СО 2 является потенциально токсичным для человека даже в низких концентрациях, принимая во внимание его воздействие на клеточную мембрану и биохимические изменения, такие, как увеличение напряжения CO 2 в крови, увеличение концентрации ионов бикарбоната в крови и моче, ацидоз и т. д. Для выявления того, как влияет уровень СО 2 в воздухе на процессы в организме человека, были проведены замеры уровня бикарбоната в крови и в моче человека. Всего было исследовано 593 человек из жилого, коммерческого и промышленного районов города и контрольной зоны, находящейся в экологически чистой сельской местности. Уровень бикарбоната в сыворотке крови – биологический показатель влияния СО 2 – оказался в среднем на 60 % выше у жителей Калькутты, чем у жителей сельских районов, причем самым высоким он был у жителей промышленной зоны. В городе Калькутта СО 2 присутствовал в воздухе в концентрациях от 0,03 до 0,06 %. Уровень вентиляции в помещениях был адекватным почти в 75 % жилых и рабочих помещений. Принимая во внимание то, что увеличение уровня СО 2 в атмосфере ведет к увеличению его концентрации в воздухе помещения, можно сказать, что он может явиться причиной увеличение уровня бикарбоната в крови.
В своих работах , английский ученый D. S. Robertson пишет, что уровень углекислого газа в атмосфере, при котором человечество может выжить, значительно ниже, чем предполагалось, поэтому безопасный для человека уровень углекислого газа требует пересмотра. Он рассчитал максимальный безопасный для человека уровень углекислого газа в атмосфере, составляющий 426 ррm. Ученый также считает, что под влиянием углекислого газа, уровень которого выше указанной цифры, происходит снижение величины pH в сыворотке крови, что ведет к ацидозу. Симптомы начальной степени ацидоза следующие: состояние перевозбуждения и умеренная гипертензия. Далее к ним добавляются сонливость и состояние беспокойства и как следствие уменьшение желания проявлять физическую активность. Существует вероятность того, что когда концентрация углекислого газа в атмосфере достигнет 426 ppm, а это может случиться раньше, чем через два поколения, здоровье, по крайней мере, некоторой части населения Земли, ухудшится.
Финские ученые под руководством Olli Seppanen провели 21 эксперимент на основе более 30 000 испытуемых по исследованию влияния концентрации углекислого газа. Если уровень углекислого газа в офисном помещении был ниже 800 ppm (0,08 % об.), такие симптомы, как воспаление глаз, заложенность носа, воспаление носоглотки, проблемы, связанные с дыхательной системой, головная боль, усталость и сложность с концентрацией внимания, которые возникали у сотрудников при более высокой концентрации СО 2 , значительно снижались.
В пресс-релизе ежегодной конференции Европейского респираторного общества в 2006 году были опубликованы результаты исследований, проведенных в пяти странах ЕЭС группой итальянских ученых. Исследования показали, что 68 % детей испытывают на себе негативное влияние СО 2 выше уровня 1 000 ppm. У них наблюдалось тяжелое дыхание, одышка, сухой кашель и ринит чаще, чем у других детей. Были сделаны следующие выводы: у детей, находящихся в помещении с высоким уровнем СО 2 , в 3,5 раза выше риск возникновения сухого кашля и в 2 раза – развитие ринита. Они имеют более уязвимую носоглотку, чем их ровесники.
В исследовании корейских ученых о влиянии концентрации СО 2 в помещении на приступы астмы у детей, в домах и квартирах, где живут дети больные астмой, замерялся уровень содержания веществ, которые считаются основными загрязнителями воздуха в помещении, таких как СО, NO 2 , аллергены и СО 2 . В результате данных исследований были сделаны выводы о том, что самым важным фактором, влияющим на возникновение приступов астмы у детей, является только уровень концентрации СО 2 .
Принимая допустимую концентрацию СО 2 в наружном воздухе мегаполиса 450 ppm, а оптимальную во внутреннем воздухе 800 ppm требуемый воздухообмен на 1 человека составит
L = 106 = 14,29 л/с = 51,4 м 3 /ч.
Реально концентрация в наружном воздухе может быть еще выше, а внутри помещения могут быть другие источники выделения СО 2 , например при приготовлении пищи. При разности содержания СО 2 в наружном и внутреннем воздухе 100 ppm требуемый воздухообмен составит 180 м 3 /чел., что превышает разумные пределы.
В качестве одной из мер новый американский стандарт ANSI/ASHRAE Standard 62.1-2004 предусматривает динамическое изменение режимов работы вентиляции жилых и общественных зданий. Это реализуется средствами DCV (Demand-Controlled Ventilation, DCV), путем регулирования количества подаваемого свежего воздуха сверх минимально необходимого по мере изменения реально складывающейся обстановки, определяемой количеством людей, присутствующих внутри вентилируемого объема. Объективной предпосылкой к использованию в отечественной практике является значительное удешевление за последние годы инверторных схем управления скоростью вентилятора путем использования все более доступных частотно-регулируемых приводов. Технология DCV доступно рассмотрена в статье . Однако такой мерой не всегда можно добиться эффективного результата.
О другой мере по снижению содержания вредных газов в воздухе помещений П. Оле Фангер писал в своей статье : «Очистка внутреннего воздуха от газообразных загрязняющих веществ представляет собой многообещающий метод повышения качества воздуха и частичного замещения вентиляции. Разрабатываются различные методы очистки воздуха, включая сорбцию и фотокатализ. Было показано, что последний метод обладает значительной эффективностью фильтрации, которая была зафиксирована при фильтрации отдельных химических веществ, присутствующих в воздухе. Для типичной смеси из сотен химических веществ, присутствующих внутри здания в очень малых концентрациях, при использовании указанных двух методов может быть реально достижимой эффективность очистки более 80 %, то есть очистка может снизить концентрацию загрязняющих веществ и повысить качество внутреннего воздуха в пять раз. При этом очевидно, что для повышения эффективности очистки для типичных источников загрязнения внутреннего воздуха необходимы дополнительные разработки технологии очистки и проведение дальнейших исследований».
Фотокаталитическое окисление (ФКО) является очень многообещающей технологией для уменьшения летучих органических соединений (ЛОС) в воздухе помещения. Однако исследования, проведенные Национальной лабораторией Л. Беркли в 2005 и 2007 годах, показали, что метод фотокаталитического окисления уменьшает количество ЛОС в воздухе помещения, но производит формальдегид как побочный продукт. Ученые считают, что для применения данного метода необходимо провести дальнейшее изучение, с тем чтобы либо уменьшить количество формальдегидов и ацетальдегидов, получаемых в результате реакции, либо соединить эту технологию с применением газоочистителей, для того чтобы улавливать токсичные побочные продукты до того, как они попадут в помещение. К этому необходимо добавить, что ФКО не удаляет углекислый газ, а наоборот – добавляет его в помещение, так как конечными продуктами реакции должны быть СО 2 и вода.
В настоящее время наиболее безопасными для очистки воздуха от газов в помещениях, где находятся люди, можно считать фильтры, основанные на методе адсорбции загрязняющих веществ в составе приточных вентиляционных установок. В качестве фильтрующего элемента используют активированный уголь и высокоэффективные материалы. Такие фильтры уже предлагаются на климатическом рынке.
Если возможность поддержания качества воздуха на высоком уровне при помощи вентиляционных систем не представляется возможным, можно удалять его избыток бытовыми адсорберами углекислого газа.
Выводы
1. Углекислый газ является токсичным для человека даже в относительно низких концентрациях. Его нельзя рассматривать только как индикатор эффективности вентиляции. Наилучшим для человека в помещении является уровень углекислого газа, максимально приближенный к атмосферному.
2. Концентрация СО 2 требует постоянного контроля в помещениях с пребыванием людей в промышленных городах и крупных мегаполисах, где промышленность и транспорт постоянно загрязняют атмосферный воздух углекислым и другими газами. Особенно это касается детских учреждений и других общественных зданий.
3. Рост углекислого газа в атмосфере, особенно в крупных городах из-за выбросов автотранспорта, предприятий энергетики и промышленности, вызывает необходимость в увеличении воздухообмена в помещениях с пребыванием людей. Это приводит к повышенным затратам энергии и увеличению выбросов СО 2 при ее выработке. Выход из ситуации заключается в достижении разумного оптимума между количеством приточного наружного воздуха и требуемой очисткой от углекислого и других газов.
Литература
1. ГОСТ 8050-85. Двуокись углерода газообразная и жидкая. Технические условия.
2. Стандарт EN 13779:2004. Ventilation for non-residential buildings – Performance requirements for ventilation and room-conditioning systems.
3. Гигиенические нормативы ГН 2.2.5.2100-06. Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны (дополнение N 2 к ГН 2.2.5.1313-03. Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны).
4. РД-06-28-93. Правила безопасности при строительстве (реконструкции) и горнотехнической эксплуатации размещаемых в недрах объектов, не связанных с добычей полезных ископаемых.
5. СанПиН 2.2.3.570-96. Гигиенические требования к предприятиям угольной промышленности и организации работ.
6. СНиП 41-01-2003. Отопление, вентиляция и кондиционирование.
7. СанПиН 2.1.2.1002-00. Санитарно-эпидемиологические требования к жилым зданиям и помещениям.
8. Справочник по теплоснабжению и вентиляции. Книга вторая. Вентиляция и кондиционирование воздуха / Р. В. Щекин и др. – Киев: Будiвельник, 1976.
9. СП 2.5.1198-03. Санитарные правила по организации пас-сажирских перевозок.
10. СанПиН 2.5.1.051-96. Условия труда и отдыха для летного состава гражданской авиации.
11. АВОК СТАНДАРТ – 1 2002. Здания жилые и общественные. Нормы воздухообмена. – М. : АВОК-ПРЕСС, 2002.
12. Dr. R. N. Chaudhuri, Dr. D. Sengupta. Report of the research project on evaluation of environmental N02, C02, benzene and lead exposures of Kolkata population by biological monitoring techniques.
13. D. S. Robertson. Health effects of increase in concentration of carbon dioxide in the atmosphere. Current science, vol. 90, no. 12, 25 june 2006.
14. D. S. Robertson. The rise in the atmospheric concentration of carbondioxide and the effects on human health. Med. Hypotheses, 2001, 56.
15. Olli Seppanen. Энергоэффективные системы вентиляции для обеспечения качественного микроклимата помещений // АВОК. – 2000. – № 5.
16. Stanke. В библиотеку проектировщика. Технологии DCV в системах вентиляции // Мир климата. – № 43.
17. П. Оле Фангер. Качество внутреннего воздуха в зданиях, построенных в холодном климате, и его влияние на здоровье, обучение и производительность труда людей // АВОК. – 2006. – № 2.
18. C. D. Keeling, T. P. Whorf. Atmospheric carbon dioxide record from Mauna Loa. Period of record 1958–2003. Carbon Dioxide Research Group, Scripps Institution of Oceanography, University of California, Internet source.
По-видимому, основными факторами антропогенного воздействия на климат являются увеличение концентрации парниковых газов, а также увеличение выбросов аэрозолей в атмосферу. Основные парниковые газы - это водяной пар (Н 2 О), углекислый газ (СО 2), метан (СН 4), окись азота (N 2 O), озон (О 3) и, в меньшей степени, ряд хлорфторуглеводородных соединений . Увеличение концентрации этих газов приводит к увеличению поглощения излучения от Земли, которое имеет место в инфракрасной области спектра, (максимум излучения в области 8 - 13 мк). Это вызывает подогрев атмосферы и, следовательно, в свою очередь, поверхности Земли.
Рассмотрим влияние главных парниковых газов: водяного пара и углекислого газа, с одной стороны, являющихся главным условием существования жизни на Земле, а с другой стороны, на долю которых приходится более 95 % всего парникового эффекта, подогревающего атмосферу на 33 о С. Между ними есть принципиальная разница. Водяной пар в атмосфере является наименьшей по массе частью свободной воды, находящейся в гидросфере и криосфере в основном в жидкой и твердой форме. Масса водяного пара определяется притоком солнечной радиации и температурой воздуха и не может существенно изменяться при постоянстве этих факторов. Так как в геологическом прошлом происходили заметные изменения климата, количество водяного пара в атмосфере также изменялось в соответствии с колебаниями глобальной температуры. Однако эти изменения массы водяного пара были следствием, а не причиной изменения климата. Вследствие положительной обратной связи водяной пар при каждом очередном похолодании или потеплении климата лишь усиливал этот процесс. Точно так же, водяной пар является следствием, а не причиной существования морей и океанов. Его прямое влияние на биосферу несущественно по сравнению с его косвенным влиянием как источника воды, выпадающей в виде осадков.
Углекислый газ, как в климатических условиях геологического прошлого, так и в условиях современного климата может существовать только в газообразном состоянии. При этом его концентрация в атмосфере может меняться в широких пределах вне зависимости от внешней температуры. Наоборот, рост концентрации СО 2 вследствие парникового эффекта неизбежно должен приводить к повышению глобальной температуры Земли. Наличие углекислого газа является необходимым условием существования жизни на Земле. Почти все живое вещество, создаваемое в биосфере, возникает из углекислого газа и воды в результате процесса фотосинтеза. Еще большее, чем в атмосфере (2,6 × 10 18 г), количество СО 2 содержится в водоемах, где масса этого газа достигает 130 × 10 18 г. Углекислый газ гидросферы используется в ходе фотосинтеза водных растений. Основная часть углекислого газа, израсходованного автотрофными растениями, возвращается в атмосферу и гидросферу в ходе процессов деструкции органического вещества, которые происходят при участии бактерий и других гетеротрофных организмов. Сравнительно небольшая часть органического углерода, полученного в результате фотосинтеза, сохраняется длительное время в составе почвенного гумуса, сапропеля, торфа и других органических веществ, масса которых частично расходуется в ходе окисления, но частично сохраняется и захороняется в литосфере в виде каменного угля, нефти, горючих газов и рассеянного органического углерода. Еще больший расход углекислого газа атмосферы и гидросферы связан с образованием карбонатных отложений. Процесс формирования карбонатов наиболее активно происходит в мелких водоемах, куда потоки воды выносят с поверхности континентов продукты эрозии, включающие различные соединения углерода. Из этих продуктов образуются отложения известняка, мела, доломита и других минералов, содержащих углерод. Большую роль в процессе карбонатообразования играют водные организмы, скелеты которых создаются из содержащихся в воде соединений углерода. На активное участие живых организмов, выступающих в качестве геологических факторов эволюции земной коры и тропосферы, впервые обратил внимание академик Вернадский . Открытая Вернадским роль биоты как геологической силы была обобщена Перельманом в виде закона Вернадского: суммарный эффект деятельности живого вещества за всю геологическую историю огромен, т.к. живые организмы определили геохимические особенности верхней части земной коры.
Очевидно, что без постоянного притока СО 2 из глубоких слоев Земли сохранение более или менее стабильной концентрации атмосферного углекислого газа в течение интервала времени, сравнимого с геологическими эпохами, невозможно. Углекислый газ поступает в атмосферу из глубоких слоев Земли в результате дегазации верхней мантии, а также более высоких слоев земной коры. Значительная часть СО 2 , получаемого атмосферой, выбрасывается при вулканических извержениях. Наряду с СО 2 вулканические газы обычно содержат некоторое количество окиси углерода (СО), которая в относительно короткое время окисляется и превращается в углекислый газ. Из сказанного выше следует, что скорость прихода углекислого газа как для длительных, так и для сравнительно коротких интервалов времени может изменяться в широких пределах главным образом из-за колебаний уровня вулканической активности. Планета Земля стареет, и наряду с ритмическими колебаниями имеется общая тенденция к уменьшению вулканической активности, что должно вызвать, соответственно, снижение количества СО 2 .
Многие начинающие обладатели аквариумов задумываются, для чего все-таки требуется углекислый газ. Он оказывается необходимым для рыбок, так как в противном случае они не смогут активно развиваться.
СО2 — что это такое?
Рано или поздно перед каждым серьезным аквариумистом встает вопрос о снабжении аквариума СО2. И неспроста. Зачем он нужен аквариумным растениям? Итак, СО2 — что это такое?
Все мы знаем, что водные растения питаются в первую очередь углекислым газом, растворенным в воде. Это и есть СО2. В природе растения получают его из водоема, в котором растут. Поскольку объем воды в природных водоемах очень велик, его концентрация в них обычно постоянна. А вот про аквариумы этого сказать нельзя.
Растения быстро используют весь газ СО2 из аквариумной воды, а само по себе восстановление его концентрации не произойдет, потому что аквариум является замкнутой системой. Даже содержащиеся в нем рыбки не смогут восполнить недостаток СО2, так как они выдыхают настолько мизерную его долю, что ее никогда не хватит для растений. А в итоге аквариумные растения перестают расти.
Кроме того, что растения перестают расти из-за недостатка СО2, вода, в которой его содержание низкое, имеет повышенную жесткость (рН), что губительно для них. Даже неопытные аквариумисты наверняка замечали, что после добавления растений водопроводная вода становится более жесткой, чем была в пустом аквариуме. Это объясняется тем, что углекислый газ способствует появлению в воде угольной кислоты, а она понижает жесткость. То есть важно понимать: чем меньше СО2 в воде, тем выше ее рН.
Газировка как источник СО2 для аквариума
Для наноаквариумов до 20 литров связываться с баллонной установкой СО2 не каждый захочет. Можно сделать генератор СО2 на браге или соде. Но можно поступить проще. Есть древний и незаслуженно забытый метод подачи СО2 это использование газированной воды. Газированная вода это своего рода концентрат углекислого газа уже растворенного в воде.
Содержание СО2 в газировке обычно около 5000-10000мг/л, а после открытия бутылки стремится к 1450мг/л. Если посчитать сколько необходимо газированной воды для доведения концентрации СО2 в аквариуме до 10мг/л, то выходит довольно экономично. Свежей газировки нужно всего 20мл на 10л аквариумной воды, что даст 10мг/л СО2 в аквариуме. Достаточно просто по утрам вносить газировку вместе с удобрениями. После стояния, вносить газировку можно и в больших количествах, так как углекислый газ выветривается.
Приблизительно, 1 литра газировки хватит для 10-20л аквариума на месяц. Подойдет любая газированная вода, конечно, кроме соленой. Лучше использовать самые дешевые. Их обычно делают из водопроводной воды:). Больше чем до 10мг/л лучше концентрацию СО2 таким методом не доводить.
Во-первых, не известно сколько углекислоты содержит ваша газировка 5000мг/л или 10000мг/л. Во-вторых, большие колебания концентрации СО2 в аквариуме не желательны. После добавления газировки концентрация будет постепенно снижаться из-за потребления аквариумными растениями. Постоянные колебания СО2 от 10мг/л до нуля и обратно не страшны. Но колебания от 20-30мг/л до нуля гораздо хуже для баланса в аквариуме.
Плюсы метода:
- не нужен реактор для растворения СО2 и счетчик пузырьков, так как СО2 уже растворен в газированной воде;
- простота использования;
- экономичен в краткосрочной перспективе;
- удобен для наноаквариумов.
Минусы метода:
- нестабильная концентрация СО2 в аквариуме;
- цена 1 грамма СО2 самая высокая из перечисленных методов, то есть неэкономичный в долгосрочной перспективе и для аквариумов большого объема;
- слабая подача СО2 в сравнении с другими методами.
Для большинства растений, в т.ч. редких и трудных, достаточно лишь небольшой подкормки СО2, т.е. лучше недокормить, чем перекормить. Старайтесь держать индикатор в зеленой зоне.
Тем не менее, если вдруг Вы обнаружите, что индикатор пожелтел или вовсе обесцветился, причин для паники нет.

Если с рыбами все в порядке, воду подменивать не надо, можете снять бутыль и отправить ее на время в холодильник, растения постепенно усвоят избыток углекислоты, наблюдайте за рыбами, в моих аквариумах часто зашкаливали индикаторы, особенно поначалу, но ни одного случая смерти рыб из-за отравления СО2 не было.
Когда найдены оптимальные условия насыщения, нет смысла перекрывать подачу углекислоты на ночь, небольшой утренний избыток СО2 к вечеру будет выбран растениями, такой режим повторяет суточные колебания газового состава и Рh в естественных водоемах и благотворно сказывается на росте всех растений.
ВАЖНО : при использовании в качестве реактора наружных фильтров или фильтров других моделей ни в коем случае не подаваете СО2 ДО фильтрующих элементов. СО2 должен подаваться только ПОСЛЕ всех наполнителей, иначе возможна гибель микрофлоры, населяющей фильтрующие материалы.
При перезарядке бутыли не свешивайте свободный конец трубки с края аквариума – давление фильтра может перегнать воду через край и она потечет на пол.
Если Вы забывчивы, не советую так же пользоваться колесиком зажима на трубке капельницы. Если закрыть его надолго во время брожения, возросшее внутри давление может разорвать бутыль.
Не надо ставить бутыль на теплые лампы аквариума – брожение пойдет слишком интенсивно и закончится в короткий срок.
Если в Вашем хозяйстве несколько аквариумов, советую снабдить каждый из них своей персональной бутылью. В моем хозяйстве есть разные аквариумы емкостью от 150 до 400 литров, я перезаряжаю все бутыли сразу, примерно раз в 10-15 дней.
Брага
Брага – это основа СО2 для аквариума, которая состоит из дрожжей, воды и сахара. Дрожжи бывают хлебные, сухие и пивные, но для браги больше подходят сухие и пивные. Все ингредиенты смешиваются и запечатываются в вакуумной ёмкости. Процесс брожения дрожжей полностью отличается от процесса фотосинтеза, вследствие чего выделяется необходимый газ для резервуара путём использования сахара дрожжами.
Для изготовления бражной установки понадобятся 2 прозрачные пластиковые бутылки объёмом 1,5–2 л. В бутылку засыпается сырье из воды, дрожжей и сахара и закрывается. Генератор СО2 соединяется с газовым сепаратором посредством трубки или шланга (для трубки подойдёт обычная капельница). Для растворения газа в аквариум нужно присоединить фильтр с трубкой и специальной помпы для распыления. Давление может разорвать бутыль, поэтому для предотвращения этой проблемы используют клапан, вставленный в медицинский шприц. Он устанавливается на крышке главного сосуда и служит счётчиком пузырьков газа. Удобнее всего изготовить систему СО2 с двумя генераторами.
Баллонная установка
Подача СО2 в некоторые аквариумы больших размеров производится посредством системы, состоящей из основного баллона, редуктора, которые не допускает того, чтобы давление газа поднималось. Электромагнитного и обратного клапанов, созданных для контроля газа и предотвращения выброса в редуктор воды. А также в состав системы входит трубка, по которой газ попадает в аквариум и специальный быстрый распылитель углекислоты – диффузор. Подобная система называется баллонной установкой, она удобна в использовании и выглядит эстетично (не портит внешний вид аквариума).
Средства контроля за содержанием углекислого газа в аквариуме.
Для контроля поступления СО2 в аквариуме существует, собственно, один способ- замер кислотности (РН) и карбонатной жесткости (КН) с последующим определением концентрации СО2 в воде с помощью таблицы Таблица содержания углекислого газа в аквариуме (CO2, СО2) . Несколько удобнее эту процедуру делать с помощью калькулятора calculator.php#j Одна особенность- в нашем калькуляторе, при вводе значения РН, в качестве десятичного знака нужно использовать не запятую, а точку.

На этом же принципе, основано и использование дроп-чекера (ДЧ). ДЧ представляет из себя емкость, в одну часть которой залит эталонный индикаторный раствор- вода с КН 4, в которую добавлен индикатор- аналог теста на РН. Вторая часть емкости открыта и в нее попадает аквариумная вода. Обе части емкости выполнены таким образом, что между индикаторным раствором и аквариумной водой всегда имеется воздушная подушка. Эдакий «сифон наоборот».
При повышении концентрации СО2 в аквариумной воде, часть его выходит из нее в воздушную подушку, выравнивая парциальное давление СО2 в воде и воздухе над ней. Одновременно с этим, СО2 растворяется в индикаторном растворе, так же выравнивая парциальное давление. В результате, концентрация СО2 в аквариумной воде и в индикаторном растворе становятся одинаковыми.
С изменением концентрации СО2 в индикаторном растворе, изменяется и его РН, на что индикатор реагирует изменением цвета. По его цвету и можно судить о концентрации СО2. При уменьшении концентрации СО2 в воде, все происходит в обратном порядке. Такой себе постоянно действующий тест на РН Дроп чекер своими руками (DIY CO2 Drop Checker) .
Очень удобный девайс с одним существенным недостатком- пока все вышеописанные процессы пройдут, проходит 2-3 часа- время запаздывания ДЧ. За это время можно и рыбу всю положить. Поэтому, я бы на этапе отработки подачи газа рекомендовал бы пользоваться тестами и калькулятором, чтоб иметь «мгновенные» значения, а ДЧ использовать для общего контроля в уже установившемся режиме.
Счетчик пузырьков.
Для отслеживания количества СО2 поступившего в аквариум используется счетчик пузырьков- небольшая прозрачная емкость, заполненная водой и врезанная в магистраль подачи газа. СО2, проходя через него визуально наблюдается в виде пузырьков, проходящих через воду с равными интервалами один от другого Продам баллооборудование CO2, диффузоры (СПб) (пятое фото слева, седьмое фото справа). Опять-таки, не понимаю, зачем платить, когда с таким же успехом можно взять для этой цели фильтр от капельницы))).
Под счетчиком пузырьков желательно ставить обратный клапан- чтоб в случае падения давления газа, вода не вытекла в трубку вниз. Обратный клапан, так же, следует ставить перед рябиновой веткой или диффузором в аквариуме. Обратный клапан в системе подачи углекислого газа для аквариума
-Пирлинг- пузыряние растений. Несколько субъективный метод контроля за содержанием СО2 в аквариуме.
Однако, факт остается фактом- опытный аквариумист, зная химсостав воды в своем аквариуме и свое освещение, по пузырянию растений вполне может сделать достаточно точный вывод о концентрации СО2 в воде. Тем более, что разные растения на это реагируют по-разному.
Простейший способ подачи углекислого газа
Основным элементом является сосуд (двухлитровая пластиковая бутылка, к примеру) с обыкновенной брагой. В бутылку засыпается сырьё для брожения:
- сахар - 300 г;
- дрожжи - 0,3 г.
Сырьё заливается 1 литром воды, сахар не размешивается. В бутылочную пробку одним концом герметично вставляется трубка (шланг), а другой конец трубки опускается в воду аквариума. С началом процесса брожения выделяющийся углекислый газ отводится в акву.
Для предотвращения попадания сгустков смеси браги в аквариум к основной ёмкости можно привязать малую пластиковую бутылочку и присоединить ещё 2 трубки, чтобы газ и продукты брожения сначала попадали в малую ёмкость, а уже потом в аквариум.
Этот способ имеет существенные недостатки:
- невозможность регулировки количества подаваемого в аквариумную воду углекислого газа и нестабильность его подачи;
- малая продолжительность работы такой системы - до 2 недель.
Генератор СО2 своими руками
Для изготовления работоспособного генератора газа с регулировкой подачи потребуется немного больше материалов и трудозатрат.
Принцип действия установки состоит в постепенной подаче лимонной кислоты из одного сосуда в другой, где находится пищевая сода. Кислота смешивается с содой, и выделяющийся в результате химической реакции СО2 поступает в аквариумный резервуар. Рассмотрим процесс изготовления по этапам работы.

Создание аппарата
Берут две одинаковые литровые пластиковые бутылки. В крышечках необходимо аккуратно просверлить сверлом по дереву по 2 отверстия для последующей установки трубочек (шлангов). Одна трубка с обратным клапаном соединяет ёмкость №1 с ёмкостью №2.
Во вторые отверстия крышечек вставляется трубка-тройник, одно ответвление которой тоже имеет обратный клапан. Шланги с обратными клапанами должны быть вставлены в ёмкость №2, а на центральное ответвление тройника устанавливается небольшой краник для регулировки потока.
Необходимые реактивы
В бутылку №1 заливается водный раствор соды (60 г соды на 100 г воды), а бутылку №2 - раствор лимонной кислоты (50 г кислоты на 100 г воды). Крышечки с трубками должны быть плотно навинчены на бутылки.
Все стыки и отверстия необходимо надёжно загерметизировать смолой или силиконом во избежание утечки газа. Концы первого шланга должны быть опущены в растворы, а левую и правую трубочки тройника необходимо установить выше уровня растворов - через них будет проходить СО2.
Начало работы
Для запуска процесса генерации газа нужно надавить на бутылку №2 (с лимонной кислотой). Кислота через первый шланг поступает в раствор соды, и происходит реакция с выделением углекислого газа. Обратный клапан патрубка не позволяет раствору соды под давлением попадать в ёмкость №2.
Выделяющийся газ проходит по двум направлениям:
- в бутылку с лимонной кислотой, создавая давление для непрерывной генерации,
- в центральный патрубок тройника, по которому СО2 поступает в аквариум.
С помощью краника можно регулировать газовый поток. Если вместо самодельного тройника использовать шланги от медицинской капельницы, то дополнительно появится счётчик пузырьков газа, что очень удобно для создания точной концентрации СО2 в аквариумной воде.
Некоторые хозяева декоративных рыбок с помощью переходника присоединяют выпускной шланг к выходному отверстию внутреннего фильтра. В данном случае происходит диффузия углекислого газа, и он лучше усваивается растениями.
Каждый аквариумист должен понять - растения состоят из углерода [C] на 40-50% (сухого веса), а в аквариуме без подачи CO2 его настолько мало*, что им просто негде взять основной строительный материал для своих клеток! Это наглядно видно в Таблице состава растений.
Растения используя световую энергию, кислород, углерод и водород осуществляют фотосинтез.
С помощью фотосинтеза углеводы, например глюкоза, получается из двуокиси углерода CO2 по реакции:
CO2
+ 6 H2O + 674.000 кал ---> C6H12O6 + 6H2O
или CO2 + 2H2O --> + O2 + H2O
Как видно это невозможно
без достаточного количества CO2.
По этой формуле также видно, что процесс фотосинтеза растений требует определенного уровня энергии света (~674,000 кал). Если свет недостаточно яркий, фотосинтез происходить не будет. При уровне освещенности близком к оптимальному **, фотосинтез будет происходить все быстрее и быстрее.
Данные научных исследований (1994) фирмы Tropica ()
, крупнейшей компании по выращиванию аквариумных растений, показали что в природе при достаточном количестве питательных веществ CO2 + свето
являются главными лимитирующими факторами роста растений. При условии насыщения воды всеми питательными веществами, в компании Tropica две недели наблюдали результаты по выращиванию риччии, и получили следующие результаты:
- нет подачи CO2 + низкая освещенность - рост растений = 0. (за две недели почти никакой прибавки массы листьев)
- при малой подаче CO2 + низкой освещенности рост увеличивается в 4 раза (по причине низкой точки компенсации, LCP у водных растений)
- малой подаче CO2 + высокой освещенности рост усиливается в 6 раз.
- при сильной освещенности + высокой подаче CO2 1 грамм риччии вырастет в 6,9 грамм, это дает ежедневный прирост массы на 9,2% ! (см. график)
Если подавать много CO2 при слабой интенсивности света получим совсем незначительное усиление роста растений (зеленая линия), как и при усилении одного только освещения (синяя линяя). Но при сильном свете и высокой концентрации CO2 в воде (~15-25мг/л) эффект просто потрясающий (красная линия). При интенсивности освещения ниже точки компенсации света (LCP) рост растений останавливается и энергии света хватает только на поддержание жизни растения (желтая линия).

Даже средний уровень подачи CO2 в плохо освещенном аквариуме приводит к 4-х кратному увеличению роста растений, потому что может производится больше хлорофилла без фатальных последствий для баланса энергии растения - растение тратит меньше энергии и ресурсов для извлечения CO2 из воды, и остается больше энергии для оптимизации переработки световой энергии в ткани растения. В результате хотя не увеличивалась интенсивность освещения, растение может более эффективно использовать уже имеющийся свет. Очевидно, что выгода от увеличения интенсивности освещения + подачи CO2 превосходит эффект от повышения только одного из них.
Этот график подтверждает истину что каждый фотон независимо от угла падения на лист растения используется для реакции фотосинтеза, т.е. использование в процессе этой реакции молекул CO2 напрямую
зависит от интенсивности освещения.
Прим.: одно дело получить максимальный рост, другое - Стабильность .
Из вышеизложенных фактов следует что: интенсивность освещения должна соответствовать количеству подаваемого в аквариум CO2 и наоборот.
Если освещение в аквариуме слабое, все равно стремитесь к достижению концентрации CO2 не менее 15 мг/л (это малая подача)! Еще лучше - всегда поддерживать ~30мг/л.
У подавляющего большинства любителей растений не владеющих правильной методикой недостаток света и отсутствует подача CO2, поэтому темпы роста растений соответствуют желтой
линии, в лучшем случае зеленой
. Увеличив только свет, вы улучшите рост и получите синюю
линию, но в этом случае возникает угроза появления водорослей. И только приведя освещенность в норму и сделав подачу CO2 ускорение роста будет в несколько раз (красная линия
)! Это заставит растения расти невиданными темпами.
Зачем это нужно? Во первых - вы не будете ждать несколько месяцев пока композиция приобретет запланированный вид - это произойдет всего за 1,5-3 месяца; во вторых - это дает возможность часто подрезать растения и точно формировать композицию; в третьих - только достаточно молодые листья водных растений имеют идеальное состояние и соответственно, идеальный внешний вид. Только при очень быстром росте растений можно получить совершенный аквариум, подобный работам Takashi Amano .
почему именно co2 ?
Растениям углерод доступен в двух формах: газообразной в виде оксида углерода , и растворенной в воде как бикарбонат . Растения предпочитают потреблять CO2 не из бикарбоната, а как чистый CO2 без больших энергетических затрат, кроме того многие растения не могут напрямую утилизировать бикарбонат для фотосинтеза. Растворенный в воде оксид углерода (CO2 - углекислый газ) дает растениям самый лучший и наиболее легко ассимилируемый источник углерода.
какая концентрация co2 нужна растениям?
Оксид углерода CO2 хорошо растворяется в воде. Концентрация CO2 в воде и воздухе уравнивается при 0,5мг/л. К сожалению CO2 растворяется в воде в десять тысяч раз медленнее чем в воздухе. Эта проблема решается относительно толстым недвижимым слоем (unstirrable layer или Prandtl boundary) который окружает листья водных растений. Недвижимый слой водных растений это слой спокойной воды через которую газы и питательные вещества должны диффундировать чтобы достичь листьев растений. Его толщина около 0,5мм, что в десять раз толще чем для наземных растений.
Как следствие этого, чтобы обеспечить оптимальный фотосинтез водных растений концентрация свободного CO2 в воде должна быть порядка 15-30мг/л
, при этом нельзя превышать предельно допустимую концентрацию CO2 для рыб 30мг/л.
Низкая растворимость CO2 в воде, относительно толстый недвижимый слой и высокая концентрация CO2, нужная для обеспечения фотосинтеза подсказали одному ученому утверждение: "Для пресноводных растений, естественный уровень соединений углерода в воде является главным сдерживающим фактором фотосинтеза..." (подробнее см. оптимальное насыщение воды CO2 и )
Прим.: ADA используя диффузор и отключение CO2 на ночь подает углекислоту до значительно больших значений, хотя из-за интенсивного потребления растениями концентрация в воде не превысит 30мг/л. Получаемый туман из мелких пузырьков дает газообразный CO2, что значительно ускоряет рост растений.
co2 и кислород
Вопреки распространенному заблуждению, углекислый газ не вытесняет из воды кислород*** и не ограничивает его доступность для дыхания рыб - они успешно сосуществуют. Наоборот - благодаря хорошему росту растений концентрация кислорода днем, когда растения активно фотосинтезируют, достигает 11 мг/л, что намного выше 100% границы насыщения при температуре воды 24С, и к утру падает только до 8,0 мг/л. Для нормальной жизнедеятельности рыб достаточна концентрация растворенного кислорода в воде 5 мг/л (насыщение 60%). На самом деле в аквариуме с растениями качество среды настолько выше чем в обычном аквариуме, что рыбы будут в значительно лучшей форме, и большинство видов будет размножаться без всякой стимуляции к нересту, а мальки прекрасно вырастают в общем аквариуме (если им подходит тот корм что размножается в общем аквариуме, мелкий циклоп и пр.). При подаче CO2 и pH 7.2-7.5 даже содержание малавийских цихлид дает прекрасные результаты с регулярным размножением в общем аквариуме.
отключение co2 на ночь
Что касается вопроса выключать подачу CO2 на ночь или нет, то здесь есть два мнения. Одни источники утверждают что этого делать не нужно. Считают что если в аквариуме до 1200 литров нормально буферизированная вода (с dKH=2-4), и он не перенаселен рыбами, содержание кислорода к утру остается достаточно высоким (8мг/л), а pH более-менее стабилен. Использование подачи CO2 по ADA при помощи диффузора имеет свои особенности, позволяет отключать подачу газа на ночь без опасений, и дает неожиданно хороший эффект !
Растения потребляют CO2 только во время фотосинтеза, поэтому подача газа ночью просто не нужна. Максимальный фотосинтез происходит утром
, когда в воде много свободного CO2, а уровень O2 и солнечной иррадиации наиболее низкие
[см. ], поэтому важно утром перед включением света насытить воду углекислотой включив подачу CO2 за 1-2 часа ДО включения света. При Ступенчатом методе освещения активность Rubisco значительно больше и потребность в CO2 утром ниже чем при равномерном и потребление CO2 эффективнее, поэтому включать подачу CO2 за 1-2 часа до включения света не нужно. [см., раздел Metabolic flexibility]
Обычно выбор делается на основании личных предпочтений. Если подавать CO2 методом распыления на ночь ее отключают, если же методом растворения (в канистровый фильтр) то нет, позволяя сэкономить на стеклянном диффузоре и убрать один прибор из аквариума, значительно сократить расход газа, и сделать обслуживание системы проще. Распыление может давать несколько лучший вид растений и очень хорошо очищает воду от взвеси. В любом случае одним из решающих факторов стабильности аквариума является стабильность подачи CO2. Оба варианта работают хорошо.
баланс света и co2
Интенсивность освещения и подача CO2 должны соответствовать друг другу.
Исследования фирмы Tropica подтверждают то, что говорил Takashi Amano для Aqua Journal : "Ватты света должны соответствовать количеству подаваемого CO2. Если свет слишком интенсивный и растения не получают достаточного количества CO2, сильный свет принесет больше вреда чем пользы."
тоже говорит что слишком много света без соответствующей подачи CO2 приносит растениям только вред. Для фотосинтеза растений не всегда нужно очень много CO2, что видно из формулы фотосинтеза: 6 CO2 + 12 H2O --> C6H12O6 + 6 H2O. При этом растения могут выделять кислород (активно фотосинтезировать) даже БЕЗ поступления питательных веществ! Это не может продолжаться долго. Растения становятся все более слабыми несмотря на активный фотосинтез. При этом потребление ими фосфатов и азота из воды уменьшается, а этим сразу воспользуются водоросли.
Если много света но недостаточно CO2, растения не будут активно расти и появятся водоросли. Вносимые жидкие удобрения (например PMDD) еще больше усугубят проблему. С другой стороны если недостаточно света, а CO2 подается много, растения не потребляют CO2 и его концентрация может превысить допустимый предел став токсичной для рыб и беспозвоночных (>30мг/л). Некоторые растения более светолюбивые чем другие, например длинностебельные с очень тонкими листьями. Требуя больше света они, соответственно, требуют и большей подачи CO2 ! Как говорит Takashi Amano, нет сложных и простых растений, просто есть светолюбивые и тенелюбивые - кроме разного необходимого количества света и CO2 они ничем не отличаются. Следует с самого начала создания NA определить мощность флуоресцентных ламп и подачу CO2, чтобы в последующем эти факторы не уменьшали рост растений - будет проще определение их потребности в других питательных веществах. [См. Ole Pedersen, Claus Christensen and Troels Andersen , 1994 www.tropica.com.]
сколько подавать co2
Как сделать pH и насыщение воды CO2 идеальными для растений? Сделать в аквариуме KH=min.4 градуса, и отрегулировать подачу CO2 так, чтобы pH установился на уровне 6,8 утром и 7,2 вечером - в результате средняя концентрация CO2 будет ~15-30мг/л.
pH и KH это то что каждому, кто держит аквариум с растениями абсолютно необходимо понимать. Это два взаимосвязанных понятия.
pHэто мера кислотности воды
(acidity). Ее определяет негативный логарифм количества гидроксидных ионов (H+) в воде - чем их больше, тем ниже pH. pH реакция воды может быть кислой (мене 7,0), нейтральной (pH=7,0) или щелочной (pH>7.0).
Карбонатная жесткость kН(т.е. карбонатная жесткость) это мера щелочности воды. KH указывает на способность удерживать pH на определенном уровне, то есть является показателем буферных свойств воды
. Она постоянно изменяется, поэтому ее называют временной жесткостью
. Значение KH это количество бикарбонатfов в воде, которые нейтрализуют действие постоянно образующихся в аквариуме кислот понижающих pH, удерживая тем самым pH от понижения.
В природе концентрация CO2 в воде редко бывает столь высока как того требует подводный сад, но в естественных водоемах соотношение поверхности воды, через которую поглощается CO2, к массе растений несоизмеримо больше чем в аквариуме, и его запасы постоянно возобновляются течением и выделением из донных отложений. Без искусственного обогащения воды CO2 весь доступный в аквариуме углекислый газ будет использован растениями за первые час-два после включения освещения и рост остановится.
На практике темпы подачи можно определить так (при 100% эффективности реактора):
при kH=2-4 подача должна быть 1 пузырек в минуту на каждые 10л воды в аквариуме. Это даст CO2=7-19мг/л при pH=6.8-7.2.
О том как использовать значительно большую подачу говорилось ¬.
Эти рекомендации дают только ориентировочные безопасные рамки
подачи CO2. Наиболее эффективный способ подачи CO2 это метод распыления . Это можно сделать при помощи стеклянного диффузора, диффузора-помпы , или реактора конструкции Tom Barr .
влияние co2 на pH
co2 понижает pH
При подаче CO2 в аквариум в воде образуются небольшие количества угольной кислоты (0.1-0.2%), она диссоциирует на ион и бикарбонат (основа KH), концентрация ионов H+ увеличивается, понижая рН - значит подавая CO2 мы можем понижать рН в аквариуме одновременно давая важнейший питательный элемент для роста растений - углерод [C].
С понижением pH в воде увеличивается доля углерода в форме CO2, т.е. растворенного
в воде CO2 становится больше чем бикарбонатов. (см. ниже в разделе "pH") Так как на значение pH влияет карбонатный буфер KH и концентрация CO2 в воде, то взаимосвязь (pH <-> KH <-> растворенный CO2) является жесткой
. В связи с тем что pH в основном определяется наличием карбонатного буфера KH, количество подаваемого CO2 зависит от того, кокой нам нужен уровень pH в аквариуме с растениями. То есть в тройке (pH - KH - CO2) pH и KH являются заданными
величинами, а подача CO2 будет регулироваться для обеспечения одновременно оптимального уровня pH=6.8-7.2 и концентрации углекислого газа в воде. Для получения оптимальной концентрации CO2=15-30мг/л и pH=6.8-7.2 вода должна быть с исходным KH=2-8, что соответствует воде с общей жесткостью dGH=4-10.
но какими должны быть kH и pH?
pH
Оптимальным для роста растений является pH=6.8-7.2. Почему именно 6,8-7,2?
Растениям нужно много CO2
.
Для хорошего роста растений нужно много CO2. Как говорилось ранее, для растений лучший источник углерода это CO2. Но в воде углерод может существовать в двух формах: углекислого газа CO2 растворенного в воде, и бикарбоната . Растворенный в воде газообразный CO2 непосредственно поглощается ратениями путем диффузии через стенки клеток. Бикарбонат же содержит химически связанный CO2 - то есть НЕ доступный для непосредственного потребления растениями - они должны сначала поглотить HCO3- и уже внутри клеток извлечь CO2. Это сложный и энергоемкий процесс, и не далеко все растения могут это делать (подробнее).
В мягкой и кислой воде с pH<7.0 большинство углерода (~70%) будет находится в виде CO2 прекрасно усваиваемого растениями, и только 30% в виде бикарбоната , то есть: чем ниже pH, тем больше углерода находится в легко доступной для растений форме - растворенном в воде газообразном CO2! Это говорит о том что при равной подаче CO2 в аквариуме с мягкой водой с KH=2-6 (dGH=4-6°) растения получают больше CO2 чем в аквариуме с более жесткой водой.
Стабильность pH при протекании биологических процессов в аквариуме.
Буферизация это результат действия химических свойств слабых кислот. Когда слабая кислота диссоциирует в воде, отношение сформировавшихся пар кислота-основание имеет логарифмическое отношение. Если распечатать график отношения кислота/щелочность (acid-bace ratio) относительно pH, увидим что выше или ниже определенного значения pH, кривая зависимости практически плоская, то есть когда кислоты или основания добавляются в воду, pH не будет существенно изменяться! При определенном pH, называемом точкой равновесия
, кривая практически плоская, означая что добавление кислот и оснований очень мало изменят pH. Заметьте что может быть больше чем одна точка равновесия, и они разные для разных кислот.
Нас же интересует угольная кислота , точка равновесия которой pH=6.37
. Это идеальное значение
для аквариумных растений, так как желаемый уровень pH чуть-чуть выше этого значения и обычно имеет тенденцию к понижению
потому что в аквариуме в процессе нитрификации потребляется много щелочного буфера - бикарбоната HCO3-. Так как начальный уровень pH ВЫШЕ точки равновесия и любое смещение будет по направлению к ней, довольно много кислоты может быть "буферизировано" перед тем как pH упадет ниже этой точки. В этом залог стабильности pH, и таков pH (6.6-7.2), выбранный T. Amano как оптимальный для Nature Aquarium.
Прим.: возможно на этом явлении основан метод Krause определения оптимального pH воды для конкретного аквариума.
Соотношение аммония NH4+ и токсичного аммиака NH3.
аммоний может существовать и в форме аммиака , который очень токсичен для всего живого (токсичен уже при концентрации 0,06 мг/л). Соотношение аммоний NH4+/аммиак NH3 в аквариуме в основном зависит от значения pH. Чем ниже pH, тем меньше токсичного аммиака. При pH=7.0 его только 0,5%, но при повышении pH до 7,5 аммиака уже 4%. То есть в восемь раз больше! Простое правило: при pH больше 7.0 начинает значительно увеличиваться доля токсичного аммиака. При pH=6.8-7.2 в NA будет доля токсичного аммиака в пределах 0,4-0,8%. Так как в NA поддерживается очень низкий уровень аммония/аммиака, то даже при ухудшении ситуации, pH в пределах 6,8-7,2 гарантирует отсутствие токсичного аммиака .
Активность нитрифицирующих бактерий.
При pH=6,6 нитрифицирующая деятельность бактерий составляет примерно 85% от максимального уровня. Это значит что в NA при pH=6.8-7.2 бактерии никогда не работают на максимуме, и при незначительном ухудшении параметров воды всегда смогут немного увеличить активность и справится с увеличившейся нагрузкой, сохранив стабильность аквариума. Таким образом создается такой же запас стабильности, как и в описанном выше примере с точкой равновесия pH. (Наиболее активно нитрификация протекает при pH=7,5-8,5; ниже pH7,5 она замедляется.)
KH
Теперь нужно определить какое должно быть значение KH. Мы выяснили, что в аквариуме для оптимального роста растений нужно поддерживать pH=6.8-7.2.
Мягкая вода с kH=2-5 сама по себе кислая и а в т о м а т и ч е с к и буферизируется на уровне pH=6.0-7.3 потому что большинство углерода в ней содержится в форме углекислого газа а не угольной кислоты , значит во избежание падения pH ниже нормы при подаче углекислого газа минимальный уровень kH до подачи CO2 в аквариум должен быть min.KH=4.0.
Почему не больше? Потому что если начальный уровень kHmax.>7.0, т.е. вода слишком жесткая, она будет иметь начальный pH~7.8, и для достижения нужного уровня pH потребуется превысить предельно допустимую для рыб концентрацию CO2 в 30мг/л. В этом случае просто не получится снизить pH до оптимального уровня.
Если же KH слишком низкий (kH<2), при завышенной подаче CO2 или повышении уровня нитратов возникнет угроза внезапного резкого
падения уровня pH ниже 6.8 (т.н. обвал pH), что губительно для растений и рыб.
Для поддержания стабильного pH вода до начала подачи CO2 должна иметь минимальный уровень kHmin.=4 , чтобы в любой момент не исчерпался карбонатный буфер воды, и это не привело к обвалу pH. Есть и другая возможность этого избежать - субстрат с хорошими буферными свойствами который будет буферизировать pH за счет щелочности а не kH.
Далее. Вы помните, что взаимосвязь (pH - kH - CO2) является жёсткой , значит по Таблице 1 зависимости одной величины от другой по требуемому pH и заданному KH можно определить, какая будет концентрация CO2 при выбранных нами kH и pH.

По таблице видно, что при pH=6.8-7.2 и KH=4-5 концентрация CO2 будет 7,6-23,8 мг/л. Подавая в воду такое количество CO2 при KH=4-5 мы получим и оптимальный pH, и оптимальное насыщение воды CO2 для бурного роста растений в аквариуме.
Чем ниже pH (<7.0), тем больше в воде легко потребляемого растениями растворенного CO2, и тем лучше потребление растениями всех остальных питательных веществ. В то же время kH растениям совершенно не важен, важен pH. Часто значение kH равно dH, но бывает что нет. Жесткость воды dH является несущественным фактором и второстепенна для аквариума с растениями. Высокий GH вовсе не подавляет рост растений, часто даже длинностебельные растения растут в воде с жесткостью dH 10-12 лучше чем в мягкой, и вода никогда не должна быть слишком мягкой чтобы не было радикулита .
Важно знать, что подобная взаимозависимость pH/kH/CO2 характерна только для аквариума в котором основным компонентом щелочности является карбонатная жесткость воды kH (с нейтральным грунтом без органики и без растений), в аквариуме же с растениями, с богатым органикой и гуминовыми кислотами грунтом kH в буферной системе играет намного меньшую роль, что делает подобные таблицы и pH-контроллеры бесполезными. Единственный верный способ контролировать концентрацию CO2 - дропчекер с калиброванным раствором kH=4.00.
нужен ли нам вообще kH ?
Увеличение концентрации CO2 в воде вызывает понижение как pH, так и kH. Выше говорилось о том, что при подаче CO2 обязательно должен быть некий минимальный уровень min.kH который не позволит обрушиться (необратимо резко упасть) кислотности pH когда концентрация CO2 достигнет определенной величины что исчерпает весь буфер kH, то есть буферизация pH прекратится. Проблема в том что после такого обвала после снижения подачи CO2 восстановиться kH уже не сможет. То есть нужен щелочной буфер. Это так, но аквариум с растениями может обойтись вообще без kH и иметь достаточный буфер чтобы не было никакого обвала pH.
Например, если мы подаем CO2~30мг/л в очень мягкую воду, pH может быть 5.8, а kH=0. Почему тогда не происходит обвала pH и он стабильно держится? Это происходит потому, что в субстрате и в воде кроме kH (карбонат/бикарбонат) все же есть вещества буферизирующие pH, то есть еще есть щелочность, а щелочность это далеко не только карбонтаная жесткость kH...
Непонимание происходит от того что путают понятия карбонтаной жесткости kH и щелочности вообще (alkalinity). Щелочность и kH совсем не одно и то же. Щелочность это способность раствора сопротивляться падению pH (буферизировать) при добавлении кислоты. Чем выше значение, тем больше щелочность. Она формируется за счет соединений карбонатов, бикарбонатов, боратов, фосфатов, гидроксидов. А KH это только мера количества карбонатов/бикарбонатов в воде. То есть мера щелочности вовсе не обязательно показывает присутствие какого либо из этих соединений, а именно карбонатов/бикарбонатов - kH. Проще говоря, щелочность это способность удерживать pH вообще, а kH это только ее часть - карбонаты/бикарбонаты. То есть отсутствие kH вовсе не означает что раствор не имеет щелочной буферной емкости. KH воды может быть 0-1, но при подаче CO2~30мг/л обвала pH не будет – он будет удерживаться не за счет kH, а за счет других соединений
дающих щелочность. Обычно kH образует большинство щелочности в системе, но в аквариуме с растениями это не так. В таких аквариумах pH удерживает буферная емкость субстрата с высоким содержанием гуминовых кислот и органики вроде ADA Aqua Soil или его аналогов , они способны делать это несколько лет. Гуминовые кислоты понижают pH до 6.8 безо всякой подачи CO2, в то же время при подаче CO2 до 30мг/л cистема уравновешивается при pH~6.5. Кроме того, часть kH и буфера субстрата постоянно возобновляется за счет подменной воды .
Но если в буферизированной иной нежели kH щелочностью при kH=0 кислотность pH не зависит от kH, как тогда контролировать концентрацию CO2, ведь тогда нельзя воспользоваться таблицей зависимости pH<->kH ? Только при помощи дропчекера с калиброванным раствором KH=4.00 .
Непонимание этих вещей иногда приводит аквариумистов к покупке самого ненужного прибора для аквариума с растениями - pH-контроллера .
Что касается благополучия растений, то им нужен определенный pH, а kH им безразличен
. KH это не общая жесткость воды dH дающая жизненно важные элементы (Ca, Mg), и он никак не влияет на рост растений, только оптимальный диапазон pH 6.8-7.2 улучшает их рост. А большинство рыб подходящих для аквариума с растениями совершенно спокойно относятся даже к pH 5.5. Поэтому kH нам не нужен, но только если есть другой щелочной буфер - в субстрате.
жесткая вода
Для наилучшего роста растений требуется оптимальный pH=6.8-7.2. Если водопроводная вода имеет KH выше чем 7.0dKH, вы не сможете достичь нужного уровня потому что концентрация CO2 превысит предельно допустимую для рыб - 30мг/л. Нужно умягчить воду смешав с водой полученной после фильтрации методом обратного осмоса (KH~0).
Распространенное заблуждение - думать что при подаче CO2 снижение уровня pH в жесткой воде будет намного больше чем в мягкой. Это не так. Что для мягкой, что для жесткой воды при подаче CO2 смещение pH будет почти равным, в том числе и суточные колебания при отключении подачи CO2 на ночь. Достаточно внимательно посмотреть Таблицу kH-pH-CO2.
мягкая вода
Слишком мягкая вода несет в себе две опасности: вероятность обвала pH при подаче CO2, и недостаток Ca+Mg. Мягкая вода обычно (но не всегда!) имеет и очень низкий kH. Если в воде отсутствует щелочной буфер подача CO2 может привести к обвалу pH. Но так как kH является только частью этого буфера, нужно ли повышать карбонатную жесткость воды kH заисит от того какой у вас субстрат. Если это аквариум с растениями c богатым органикой грунтом , kH можно не повышать . В этом случае жесткость воды повышают внося только составляющие постоянной жесткости воды, например Amania GH Booster . Если же вам нужен высокий pH+kH (например вы выращиваете растения в акваруиме с цихлидами), используйте состав повышающий и GH, и kH - Amania GH+KH Booster. Можно также смешать жесткую водопроводную воду с RO-водой для получения воды с требуемым dkH и dH. О повышении жесткости RO-воды смотри в разделе восстановление RO-воды .
что делать, если карбонатная жесткость воды (KH) слишком высока?
Можно умягчить воду до требуемых KH=4 путем очистки жесткой водопроводной воды методом обратного осмоса и смешивая ее с водопроводной.
Если карбонатная жесткость воды dKH намного выше чем требуется (>=7.0), и нет возможности умягчить воду, подавать CO2 нужно до достижения концентрации не более 30мг/л (pH~7.0). Понизить pH до оптимального значения подачей CO2 не получится так как для это придется превысить допустимую концентрацию CO2 для рыб 30мг/л, но это можно сделать используя субстрат подкисляющий воду вроде ADA Aqua Soil . Никогда не используйте для этого ионнобменную колонку!
Пример. В аквариуме вода ДО подачи CO2 была KH=10. Настроим подачу CO2. Затем раз в день измерять pH (в середине осветительного периода аквариума), если pH выше 7,0 понемногу увеличить подачу углекислого газа. Когда подача CO2 будет такой что pH=7,0 это и будет оптимальная подача углекислого газа в ваш аквариум. Еще раз измерить несколько понизившееся от подачи CO2 значение KH, и по таблице узнать концентрацию CO2. При kH=6,0 и pH=7,0 концентрация CO2 будет 18мг/л, причем утром pH будет 6,8 а вечером 7,2.
Влияние фотосинтеза растений на pH в течение суток
В течение суток фотосинтез растений влияет на pH воды в аквариуме. Растения в течение дня фотосинтезируют потребляя небольшое количество угольной кислоты , при этом pH повышается.
Независимо от того, освещено растение или нет, оно дышит 24 часа в сутки. То есть растения постоянно потребляют кислород и производят CO2. Только днем, фотосинтезируя, растения потребляют CO2 и производят кислород как побочный продукт.
В густо засаженном растениями аквариуме, свет включается в 10-00 утром, и выключается в 21-00 вечером. Ночью, когда света нет, растения дышат 11 часов, выделяя CO2 который понижает pH, соответственно pH упадет к утру до 6,8. Когда утром свет включается, растения одновременно и фотосинтезируют и дышат, потребляя CO2 и выделяя кислород - pH начинает повышаться. В полдень pH поднимется до 7,0, и будет продолжать расти вплоть до 21-00 вечера, до 7,2. С выключением света pH снова начнет постепенно падать, потому что растет концентрация CO2. Чем более активно растут растения, тем больше они потребляют CO2 в течение дня, и тем сильнее к вечеру повысится pH.
Т. Амано говорит: "Для определения сколько растения потребляют CO2 можно сравнить уровень pH утром и вечером. Наименьший уровень pH будет утром - перед ВКлючением света, после ночи дыхания рыб и потребления ими кислорода и выдыхания CO2, а наивысший уровень pH будет вечером, перед ВЫключением света, после дня потребления CO2 растениями и производства кислорода. Чем больше эта разница, тем больше потребление CO2 и соответственно здоровее ваши растения." (vectrapoint.com)
Влияние процесса нитрификации на pH
В процессе нитрификации, т.е. процесса преобразования бактериями аммония NH4+ в нитрат NO3, бактерии Nitrosomonas используя NH4+ и бикарбонат HCO3- производят сначала токсичный нитрит NO2- и угольную кислоту H2CO3, а затем Nitrobacter преобразуют нитрит NO2- в безвредный нитрат NO3- в процессе чего на каждый 1мг преобразования аммония потребляется 8.64мг щелочного буфера, а именно бикарбоната HCO3-. При этом при преобразовании промежуточного метаболита азотной кислоты HNO3 до NO3 выделяется H+ что понижает pH. При преобразовании одной молекулы NH4 до NO3 высвобождается два иона H+, упрощенно процесс описывается как: NH4+ + 2O2 => H2O + H+ + H+ + NO3- (см. Understanding soil analysis data 59p.). Более детально для NH4->NO2 бактериями Nitrosomonas: 55NH4++ 76 O2 + 109HCO3- => C5H7O2N + 54NO2-+ 57H2O + 104H2CO3; для NO2->NO3 бактериями Nitrobacter: 400NO2- + NH4+ + 4H2CO3 + HCO3- + 195 O2 => C5H7O2N + 3H2O + 400 NO3- ().
В аквариуме с растениями со временем снижается как карбонатная kH и общая жесткость воды GH, так и pH. При ухудшении роста растений в воде и состояния колонии бактерий в фильтре и грунте процесс нитрификации останавливается на полпути и происходит накопление не только токсичного нитрита NO2-, но и бикарбоната HCO3-, в результате чего pH повышается.
выветривание co2
Углекислый газ очень легко выветривается из воды в окружающий воздух, так же легко как и при взбалтывании бутылки с газированной водой, поэтому нужно полностью исключить движение поверхности воды. Для этого:
- НИКОГДА не аэрируйте воду днем, только ночью
- всегда размещать выходной патрубок канистрового фильтра ниже уровня воды,
- не использовать разбрызгиватель на возврате воды в аквариум из фильтра,
- в случае применения помп для создания движения воды располагать их так, чтобы исключить движение поверхности воды.
Никогда не используйте открытые навесные фильтры типа биоколесо или водопадных как - они сильно выветривают из воды углекислый газ! Некоторые акваскейперы используют и их, но тут важно как его установить. Если повесить его на аквариум с рамкой, так что вода падает с высоты, то он выветривает CO2, если аквариум без рамок и стяжек и носик погружен в воду, то нет.
контроль концентрации co2
Для определения концентрации CO2 в воде достаточно измерить KH воды и ее pH, а затем рассчитать по формуле: CO2 = 3.0 * KH (в градусах) * 10^(7.00 - pH)
. Можно также определить по таблице или графику, или с помощью калькулятора. Этот метод имеет большую погрешность и не может служить точным ориентиром.
думать что pH и co2 это одно и то же - опасно
Если падение pH происходит от большого количества СO2 в результате дыхания бактерий в грунте, можно увеличивать подачу CO2. Но если это происходит на фоне высокого уровня нитратов, значит низкий pH вызван плохим биологическим равновесием и нужно увеличить подмену воды, понизить нитрат, и только потом увеличивать подачу CO2.
Слишком высокий pH является типичной "болезнью" аквариума на ранней стадии Setup. T. Amano в разделе о борьбе с водорослями на сайте журнала Aqua Journal обращает внимание на это обстоятельство:
"...на ранних стадиях бактерий недостаточно и pH очень высокий, понизьте pH увеличив подачу CO2." (прим.: но не ранее второй недели setup!) В зрелом аквариуме в грунте и фильтре много бактерий что pH, выделяется больше CO2, и как следствие pH ниже.
* концентрация CO2 всего 2-3 ppm: от жизнедеятельности нитрифицирующих бактерий разлагающих органику в грунте и канистровом фильтре, дыхания рыб и растений
**расчет мощности флуоресцентных ламп для NA смотри в разделе освещение.
*** смотри раздел роль кислорода.
Статья Ole Pedersen, Claus Christensen and Troels Andersen (2001) ,1994 www.tropica.com ();
она же на англ. в формате.pdf в он-лайн журнале: Interactions between CO2 and light stimulate the growth of aquatic plants. .
из статьи "", by George and Karla Booth, Copyright 2000, www.frii.com/~gbooth/AquaticConcepts/Articles/book.htm#Intro
,
by Dave Hueber t http://www.hallman.org, mailto:[email protected]
Horst, Kaspar, & Kipper, Horst E. (1986). The Optimum Aquarium. Bielefeld, Germany: AD aquadocumenta Verlag GmbH
By Ole Pedersen, Troels Andersen and Claus Christensen, This article first appeared in The 2007 vol. 20 (3) pp 24-33;
Interactions between light and CO2 enhance the growth of Riccia fluitans L.; Andersen T & Pedersen O. (2002); HYDROBIOLOGIA 477: 163-170
Andersen T, Pedersen O (2004) Higher CO2 concentrations alleviate co-limitation of light, N and P on growth in the aquatic liver wort Riccia fluitans L. XXIX SIL Congress. 8-14 August, Lahti, Finland,
by John Whitmarsh, Govindjee
Фотосинтез -
CO2 for Landscaped Aquariums - TFH, 06/00
CO2 Supplementation in thePlanted Tank - TFH, 03/96
на Petfrd.com
, by John LeVasseur
самая большая про CO2 (англ.)
""
www.rexgrigg.com - .
, Tom Barr
, Tropica ()
Understanding the General Chemistry of the Planted Aquarium, Gregory Morin, Ph.D, Seachem ()