Для бактериологического исследования воздуха используют. Исследование микрофлоры воздуха - микробиология с техникой микробиологических исследований
Большая группа приборов и устройств предназначается для концентрирования микроорганизмов в пробах из объектов внешней среды (вода, воздух), а также в пробах патологического материала от больных.
Как известно, объекты внешней среды могут быть источником массовых заражений человека и животных, в случае загрязнения их патогенными микроорганизмами. Для суждения о наличии в объектах внешней среды патогенных микроорганизмов, наиболее надежным критерием является их прямое обнаружение. Однако используемые в микробиологической практике методы не всегда позволяют делать это. Патогенные микроорганизмы трудно выявить в объектах внешней среды, так как их гораздо меньше, чем сапрофитов. Поэтому в силу антагонистических действий на питательных средах рост патогенной флоры зачастую подавляется ростом сапрофитов. Первоочередной задачей при исследовании такого объекта внешней среды, как воздух, является концентрация взвешенных в нем микроорганизмов в небольшом количестве жидкости (питательной среды).
Одним из ведущих показателей бактериальной обсемененности объектов внешней среды является показатель микробного числа. Эти данные санитарной микробиологии регистрируются подсчетом колоний, выросших на чашках Петри, с последующим пересчетом.
Значительное количество работ посвящено методам забора проб воздуха. Предложено большое количество всевозможных приборов, улавливающих бактериальные аэрозоли.
Одним из первых приборов для исследования аэромикрофлоры, который был внедрен в серийное производство в нашей стране, был прибор Кротова . Несмотря на сравнительно большое количество времени с начала его серийного выпуска (пятидесятые годы), прибор не потерял своей значимости при исследовании санитарно-бактериологического состояния воздуха закрытых помещений и до сегодняшнего дня широко используется в практике санитарно-бактериологических лабораторий.
Прибор для бактериологического анализа воздуха (прибор Кротова) (рис. 58) представляет собой цилиндр, закрывающийся крышкой, под которой имеется столик для установки чашки Петри с плотной питательной средой. Внутри цилиндра находится электрический мотор, вращающий столик с чашкой и турбинку, засасывающую воздух внутрь прибора через щель, находящуюся в крышке. Количество воздуха, просасываемого в минуту, определяется по поплавковому расходомеру и регулируется при помощи вентиля. Прибор питается от сети переменного тока напряжением 220 В. Габариты прибора в футляре -229X200X280 мм. Масса - 8 кг.
Рис. 58. Прибор для бактериологического анализа воздуха.
1 - вентиль ротаметра, 2 - ротаметр; 3 - накидные замки; 4 - диск вращающийся; 5 - крышка; 6 - диск; 7 - клиновидная щель; 8 - корпус; 9 - основание.
Подготовка прибора к работе сводится к отбору стандартных чашек Петри диаметром 100 мм и высотой 20 мм и заблаговременному заполнению их питательной средой в количестве 15 мл. Розлив и охлаждение питательных сред производится на строго горизонтальной поверхности, подсушивание в обычных условиях.
Другим прибором аналогичного назначения является пробоотборник воздуха ПОВ-1 (рис.59).
Рис. 59. Пробоотборник воздуха ПОВ-1
Забор проб воздуха производится в жидкую питательную среду, что позволяет применять специфические элективные среды и проводить специальные (направленные) бактериологические исследования.
Техническая характеристика прибора ПОВ-1
Производительность............ 20 л/мин
Питание от сети переменного тока..... 127/220 В
Потребляемая мощность..........не более 18 В А
Габариты прибора..........................170x255x285 мм
» укладки..........................170X270X350 »
Масса (с укладкой)..........................не более 15 кг
Аспиратор для отбора проб воздуха, модель 822 , выпускаемый объединением «Красногвардеец» предназначен для анализа содержащихся в воздухе примесей. На передней панели прибора (рис. 60) расположены: колодка для подключения прибора к сети 1, тумблер для включения и выключения аппарата 2, гнездо предохранителя 3, разгрузочный клапан, предохраняющий от перегрузки электродвигатель при отборе проб воздуха с малыми скоростями 4, ротаметры (конусные стеклянные трубки с поплавками) для определения скорости прохождения воздуха 5, ручки вентилей ротаметров для регулировки скорости отбора проб 6, винты крепления панели к кожуху прибора 7, штуцеры для присоединения резиновых трубок с фильтрами 8 и клемма для заземления прибора 9.

Рис. 60. Аспиратор для отбора проб воздуха. Пояснения в тексте.
На рис. 61 показан общий вид аспиратора с держателем фильтров.
Отбор проб производится при просасывании воздуха через специальные фильтры с определенной скоростью. Воздух, проходя через фильтры, оставляет на них содержащиеся в нем примеси. Зная скорость прохождения воздуха и время прохождения, можно определить объем воздуха, прошедшего через фильтр. Определив количество примесей на фильтре, можно рассчитать количество примесей в единице объема воздуха.
Аспиратор для забора проб воздуха выпускает французская фирма «Baudard» . Аспиратор представляет собой герметичный аппарат с приспособлением для укрепления мелкопористых фильтров, которые легко могут быть извлечены после просасывания через аспиратор заданного объема воздуха и, в зависимости от цели исследования, изучаться либо бактериологически (инкубирование фильтра с имеющимися на нем микроорганизмами на питательных средах), либо микроскопически (определение природы частиц, задержанных фильтром, их подсчет и т. п.).
Используемые мелкопористые фильтры могут быть либо бумажными, либо изготовленными из стекловолокна. Диаметр фильтров составляет 110 мм.
Вентилятор центрифужного принципа действия имеет две скорости и рассчитан на питание от электросети напряжением 220 В; мощность мотора - 50 Вт; производительность аспиратора - от 360 до 1000 л/мин в зависимости от сопротивления используемого мелкопористого фильтра.
При исследовании воды и других объектов внешней среды (почва), а также биологических жидкостей человека и животных (мокрота, эксудаты и транссудаты) на наличие патогенной флоры, как и при исследовании воздуха, необходима предварительная концентрация микроорганизмов в небольшом объеме питательной среды, которая в дальнейшем подвергается бактериологическому исследованию (микроскопия, посев, постановка биохимических и серологических реакций и т. д.).
Рис. 61. Аспиратор с держателем фильтров.
Однако прогресс в области методов концентрирования микроорганизмов из объектов внешней среды невелик, и большей частью приходится ограничиваться старыми методиками, представляющими различные способы накопления:
- осаждением механическими способами - фильтрация, центрифугирование, выпаривание воды;
- осаждением микробов физико-химическими методами при помощи различных коагулянтов;
- концентрированием микробов методом флотации;
- осаждением микробов специфическими агглютинирующими сыворотками;
- применением комбинированных методов концентрирования микроорганизмов, заключающихся в сочетании методов осаждения с последующим высевом на питательные среды или заражением восприимчивого лабораторного животного.
Новые методы концентрирования микроорганизмов основаны на применении некоторых физических принципов . Одним из таких физических принципов является электрофорез. Применение этого метода обеспечивает движение микробной клетки к одному из электродов, расположенных в жидкой среде, под воздействием приложенной к электродам внешней электродвижущей силы (ЭДС). Этот принцип положен в основу прибора ЭФМ-1 (рис. 62). Прибор позволяет концентрировать микробные клетки, имеющие положительный или отрицательный поверхностный заряд в малом объеме изолированной жидкости (0,01-0,02 мл).
Рис. 62. Прибор для электрофореза микобактерий ЭФМ-1.
Кроме исследований воды, прибор может быть использован для бактериологических исследований водных суспензий пищевых продуктов, различных смывов и т. п. Прибор также может быть использован и для обнаружения микроорганизмов в различных материалах, полученных от больных, в частности для обнаружения микобактерий туберкулеза в таких материалах, как спинномозговая жидкость, промывные воды бронхов и желудка, всевозможные пунктаты, моча. В мазках, приготовленных из взвеси микобактерий туберкулеза в физиологическом растворе и подвергнутых электрофоретической концентрации, количество микробных клеток увеличивается в 10-15 раз по сравнению с мазками из нативного материала.
Прибор снабжен комплектом принадлежностей, куда входят 20 небьющихся кювет емкостью по 12 мл, электроды, пипетки. Прибор питается от сети переменного тока напряжением 220 В± 10%, 50 Гц. Потребляемая мощность - не более 20 Вт. Габариты- 405X165X205 мм. Масса прибора с комплектом принадлежностей - 6 кг.
Принцип работы прибора . В специальные кюветы, из комплекта к прибору, наливают по 10 мл исследуемого материала. Над каждой кюветой с помощью зажима-держателя укрепляют пипетку, в которую помещен графитовый электрод. Часть исследуемой жидкости поднимается на 4-5 мм по капилляру пипетки и касается электрода. В зависимости от цели исследования устанавливают полярность приложенной ЭДС. Электрофорез рекомендуется проводить в течение 1-3 ч.
После выключения тока жидкость из капилляра с помощью резинового баллончика выдавливают в каплю сыворотки (нормальная лошадиная или кроличья сыворотка в разведении 1:10), предварительно нанесенную на поверхность предметного стекла, и тщательно перемешивают запаянной пастеровской пипеткой, препарат высушивают, фиксируют над пламенем горелки и окрашивают по Граму, Циль - Нильсену или другим способом.
Чтобы исключить возможность диагностических ошибок, все манипуляции проводят с тщательно обработанными кюветами, пипетками и предметными стеклами. Графитовые электроды после каждого исследования необходимо менять.
Растворы красок и кислоты должны быть тщательно проверены бактериологически.
Для увеличения точности подсчета выросших микробных колоний Киевским заводом медицинского оборудования выпускается прибор для счета колоний бактерий . Для подсчета колоний электропером на дно чашки наносятся точки в месте "нахождения каждой колонии, при этом контакты электропера замыкаются и поступающий к счетчику электрический импульс производит отсчет. Внешний вид прибора приведен на рис. 63.
Рис. 63. Прибор для счета колоний.
Для подсчета числа колоний на закрытой чашке используется карандаш или ручка, которыми ставят отметки на оборотной стороне чашки, что исключает возможность повторного учета одной и той же колонии.
Универсальный счетчик для подсчета колоний на питательной среде «Бактроник» укомплектован электронным наконечником для подсчета числа колоний на открытых чашках. При контакте с любой агаризированной средой наконечник включает электромагнитный счетный механизм и оставляет след на поверхности среды.
Такое устройство устраняет электроразряды, которые имеют место при использовании других систем.
При подсчете числа колоний на чашках с редким ростом можно использовать кнопку на панели прибора, а если необходимо- дистанционный кнопочный выключатель, что облегчает работу.
Фирма «Millipore» выпускает специальную чемодан-укладку для микробиологических исследований . Чемодан, являющийся по существу портативной лабораторией (рис. 64), обеспечивает всеми необходимыми материалами и оборудованием для исследований бактериального загрязнения воды, обнаружения микроорганизмов в воздухе и в почве, контроль температуры и роста бактерий, выявление дрожжевых грибов в окружающей среде, образование газа дрожжами, определение эффективности дезинфектантов и т. д.
Рис. 64. Чемодан-укладка для микробиологических исследований.
Для определения качества пищевых продуктов выпускается люминоскоп ЛПК-1 . С его помощью можно определять видовую принадлежность мяса, раннюю порчу свинины и свиного жира, соотношение составных частей фарша, экспертизу пищевых масел, жиров, меда и других продуктов (рис. 65).
В приборе использован принцип визуального люминесцентного анализа. Под действием ультрафиолетовых лучей пищевые продукты в зависимости от их свойства и качества начинают светиться различным цветом, а светофильтры выделяют соответствующие участки спектра. При работе с прибором не требуется затемнения помещения, исследователь огражден от воздействия ультрафиолетовых лучей.
Режим работы прибора повторнократковременный. Время работы-1 ч, пауза - 25 мин. На исследование продукта затрачивается не более 1 мин. Питание прибора от сети переменного тока - 220 В±10%. Потребляемая мощность - не более 350 Вт. Габаритные размеры - 366X185X240 мм. Масса - 6 кг.
Рис. 65. Прибор для определения качества продуктов ЛПК-1.
Смолина Света
ВВЕДЕНИЕ
Воздух является средой, содержащей значительное количество микроорганизмов. С воздухом они могут переноситься на значительные расстояния. В отличие от воды и почвы, где микробы могут жить и размножаться, в воздухе они только сохраняются некоторое время, а затем гибнут под влиянием ряда неблагоприятных факторов: высыхания, действия солнечной радиации, смены температуры, отсутствия питательных веществ и др. Наиболее устойчивые микроорганизмы могут долго сохраняться в воздухе и обнаруживаться там с большим постоянством. К такой постоянной микрофлоре воздуха относятся споры грибов и бактерий.
Количество микроорганизмов в воздухе колеблется в значительных пределах и зависит от условий, расстояния от поверхности земли, от близости населенных пунктов и т. д. Наибольшее количество микробов содержит воздух промышленных городов, наименьшее – воздух лесов, гор . Много бактерий находится в воздухе помещений, где неизбежно массовое хождение людей (кинотеатры, театры, школы, вокзалы и т. д.), сопровождающееся поднятием в воздух пыли .
Всем известно, что здоровье человека зависит от качества окружающей среды: воды, воздуха и других факторов. Школа – это такое место, где постоянно находится много людей. На своей одежде, обуви, внутри своего организма они приносят в школу много разных микробов, бактерий и других микроорганизмов.
Цель: на основе исследований определить степень загрязнения воздуха закрытых школьных помещений.
- определить количество микроорганизмов, содержащихся в воздухе различных помещений;
- изучить динамику содержания микроорганизмов в воздухе в течение учебного дня.
МЕТОДЫ ИССЛЕДОВАНИЯ
Наиболее старым методом микробиологического анализа воздуха является седиментационный метод (метод оседания Коха). Его используют только при исследовании воздуха закрытых помещений. Для этого чашки Петри с питательной средой при исследовании общей бактериальной загрязненности воздуха оставляют открытыми в местах отбора проб в течение 5-10 минут. По окончании экспозиции чашки закрывают и помещают в термостат при 37 0 С на 24 ч, а затем при комнатной температуре выдерживают еще сутки. О степени загрязненности воздуха судят по количеству выросших колоний. Данный метод пригоден для сравнительных оценок чистоты воздуха .
Учет посева бактерий из воздуха производят путем подсчета выросших колоний бактерий отдельно. Зная площадь чашки Петри, можно определить количество микроорганизмов в 1м 3 воздуха. Для этого: 1) определяется площадь питательной среды в чашке Петри по формуле рr 2 ; 2) вычисляют количество колоний на площади 1 дм 2 ; 1м 3 воздуха .
Примерный расчет. В чашке Петри диаметром в10 см выросло 25 колоний.
- определяют площадь питательной среды в чашке Петри по формуле 3,14*5 2 или 3,14*25 = 78,5 см 2
2) вычисляют количество колоний на площади 1 дм , равного 100 см 2
25колоний – 78,5 см 2
х колоний – 100 мм 2
х=25*100/78,5=32 колоний
т. е. на площади 1 дм 2 имеется 32 колонии.
3) пересчитывают количество бактерий на 1м 3 воздуха, который равен 1000л. Содержащиеся 32 колоний бактерий на площади 1 дм 2 соответствуют объему 10л воздуха. Чтобы узнать количество в1м 3 воздуха, составляют пропорцию:
х=32*1000/10=3200
Следовательно, в1м 3 воздуха содержится 3200 бактериальных телец.
Таблица 1. Критерии для оценки загрязненности помещений по числу микроорганизмов в 1м 3 воздуха
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В ходе исследований для каждой микробиологической оценки использовалось по три чашки Петри. На основании подсчета колоний, выросших в чашках Петри, была проведена оценка содержания микроорганизмов, которые содержатся в воздухе различных помещений в разные периоды учебного дня.
На первом этапе исследования было проведено сравнение данных, полученных в разных помещениях в один период времени. Наименьшее количество микроорганизмов (1571) было выявлено в классном помещении, а наибольшее (16220) – в спортзале. По-видимому это объясняется тем, что занятие физкультурой, подвижные игры приводят к поднятию пыли, следовательно и микроорганизмов, находящихся в ней.
Таблица 3. Количество микроорганизмов, содержащееся в 1м 3 воздуха школьных помещений
На втором этапе исследований был проведен сравнительный анализ загрязнения воздуха в одном и том же помещении, но в разные периоды учебного дня. Объектом для данного исследования был выбран коридор.
Таблица 4. Количество микроорганизмов, содержащееся в 1м 3 воздуха школьного коридора в разные периоды времени
1-ая чашка | 2-ая чашка | |||
До 1 урока | ||||
1 перемена | ||||
5 перемена |
На третьем этапе был также проведен анализ изменения содержания микроорганизмов в воздухе в одном помещении (класс химии), но при наличии двух дополнительных факторов: 1) проветриваемость помещения, 2) количество людей и интенсивность их передвижения.
В классе в течение всего дня были открыты форточки, что способствовало проветриванию помещения. Однако наблюдается резкое увеличение количества микроорганизмов во время 1 перемены, когда происходила смена различных классов. Таким образом, резкий скачок количества микроорганизмов, по-видимому, объясняется увеличением количества людей в помещении. При этом, проветриваемость помещения не оказывает существенного влияния на содержание микроорганизмов в воздухе в это время.
Однако на 5 перемене люди в классной комнате отсутствовали и это привело к снижению численности микроорганизмов в воздухе. Все это говорит о первостепенном влиянии именно такого фактора, как количество людей и интенсивность передвижения на степень загрязненеия воздуха микроорганизмами. Проветриваемость же помещений возможно оказывает свое влияние на общее количество микроорганизмов, но не на динамику их содержания.
Таблица 5. Количество микроорганизмов, содержащееся в 1м 3 воздуха классного помещения в разные периоды времени
На четвертом этапе был проведен сравнительный анализ классного кабинета и коридора в течение всего учебного дня.
Таблица 6. Количество микроорганизмов, содержащееся в 1м 3 воздуха классного помещения
1-ая чашка | 2-ая чашка | |||
1 перемена | ||||
2 перемена | ||||
3 перемена | ||||
4 перемена | ||||
5 перемена | ||||
После уроков |
Таблица 7. Количество микроорганизмов, содержащееся в 1м 3 воздуха коридора
ЗАКЛЮЧЕНИЕ
- Наибольшее количество микроорганизмов выявлено в воздухе спортзала, а наименьшее – классной комнаты.
- Наблюдается тенденция увеличения количества микроорганизмов в воздухе коридора в течение учебного дня.
- В воздухе классного помещения содержание микроорганизмов увеличивается во время перемен и уменьшается во время уроков.
- Количество микроорганизмов в воздухе в первую очередь зависит от численности людей в помещении и интенсивности их передвижения.
СПИСОК ЛИТЕРАТУРЫ
1 Федоров М.В. Микробиология. – М.: Гос. Изд-во сельхозлитературы,1960.– 350 с.
2 Бакулина Н.А., Краева Э.Л. Микробиология.– М.: Медицина, 1980.– 338 с.
3 Павлович С.А., Пяткин К.Д. Медицинская микробиология. – Минск: Высшая школа, 1993. – 200 с.
4 Лабинская А.С. Микробиология с техникой микробиологических методов исследования.– М.: Медицина, 1968.– 392 с.
5 Черемисинов Н.А., Боева Л.И., Семихатова О.А. Практикум по микробиологии.– М.: Высшая школа, 1967.– 168 с.
6 Шлегель Г.Х. Общая микробиология.– М.: Мир, 1987.– 566 с.
Воздух - особый объект окружающей среды, визуально не определяемый, поэтому отбор проб его имеет некоторые особенности. Для гигиенической оценки бактериального загрязнения воздуха необходимо знать, какое количество воздуха контактировало с питательной средой, т.к. нормативы регламентируют определенное количество колоний микроорганизмов, вырастающих при посеве 1 м 3 (1000 л) воздуха.
В зависимости от принципа улавливания микроорганизмов выделяют следующие методы отбора проб воздуха для бактериологического исследования:
Седиментационный;
Фильтрационный;
Основанный на принципе ударного действия воздушной струи. Наиболее простым является седиментационный метод (метод осаждения), который позволяет уловить самопроизвольно оседающую фракцию микробного аэрозоля. Посев производят на чашки Петри с плотной питательной средой, которые расставляют в нескольких местах помещения и оставляют открытыми на 5-10 минут, затем инкубируют 48 часов при 37 °С и подсчитывают количество выросших колоний.
Этот метод не требует использования аппаратуры при посеве, но его недостатком является низкая информативность, т. к. невозможно получить точные данные о количестве микроорганизмов вследствие того, что их оседание происходит самопроизвольно, а его интенсивность зависит от направления и скорости потоков воздуха. Кроме того, неизвестен объем воздуха, контактирующего с питательной средой. При этом методе плохо улавливаются мелкодисперсные фракции бактериального аэрозоля, поэтому седиментационный метод рекомендуется использовать только для получения сравнительных данных о чистоте воздуха помещений в различное время суток, а также для оценки эффективности проведения санитарно-гигиенических мероприятий (вентиляции, влажной уборки, облучения ультрафиолетовыми лампами и др.).
Фильтрационный метод посева воздуха заключается в пропускании определенного объема воздуха через жидкую питательную среду. Самым простым является способ Дьяконова, при котором воздух (10-12 л) пропускают с помощью электроаспиратора через склянку Дрекселя, заполненную стерильным физиологическим раствором. Затем из склянки отбирают 0,1-1 мл физиологического раствора и делают посев на чашку Петри с плотной питательной средой. После инкубации подсчитывают выросшие колонии и делают пересчет на 1 м 3 воздуха.
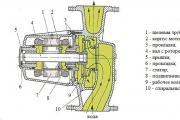
Принцип ударного действия воздушной струи нашел реализацию в приборе Кротова. В основании цилиндрического корпуса прибора установлен электромотор с центробежным вентилятором, а в верхней части размещен вращающийся диск, на который устанавливается чашка Петри с плотной стерильной питательной средой. Корпус прибора герметически закрывается крышкой с радиально расположенной клиновидной щелью, через которую аспирируемый вентилятором воздух поступает внутрь, струя воздуха ударяется об агар, в результате чего к нему прилипают частицы микробного аэрозоля. Вращение диска с чашкой Петри при включении прибора в сеть и клиновидная форма щели обеспечивают равномерный посев по поверхности агара.
Для учета количества воздуха, прошедшего через прибор, на его передней наружной поверхности установлен реометр, позволяющий регулировать скорость аспирации воздуха от 20 до 40 литров в минуту. Зная время (продолжительность) отбора пробы и скорость пропускания воздуха, определяя количество аспирированного воздуха. На конечном этапе пересчитывают величину бактериального загрязнения воздуха на 1 м 3 .
Выработка у студентов навыков организации и проведения профилактических (гигиенических) мероприятий, ведения и пропаганды здорового образа жизни, умений использовать факторы окружающей среды, в данном случае физические свойства воздуха (химический состав воздуха), в оздоровительных целях, основана на осознанном понимании связи здоровья человека с окружающей средой, факторами и условиями жизни, трудовой деятельностью, поэтому студенты должны владеть информацией по освоению методологии профилактической медицины, приобрести гигиенические знания и умения по оценке влияния факторов среды обитания на здоровье человека и населения. Тема: « Санитарно-гигиеническая оценка микроклимата помещений (химический состав воздуха)» раскрывает вопросы, связанные с основными понятиями микроклимата, факторами их определяющими и регулирующими. Гигиенические требования к химическому составу воздуха закрытых помещений. Показатели, нормативы.
Вопросы для подготовки по теме.
Характеристика микрофлоры воздуха.
Микробное число воздуха и его определение.
Санитарно-показательные микроорганизмы воздуха и их выявление.
Воздух- среда неблагоприятная для жизнедеятельности мик-роорганизмов; попадают микробы в воздух из почвы, воды, организма человека и животных и, не находя в воздухе питательных веществ, постепенно отмирают под действием солнечной радиации, высыхания,смены температуры и других, факторов.
Количество микроорганизмов в воздухе и их качественный состав колеблются в значительных пределах, в зависимости от метеорологических уеловий,расстояния от поверхности земли, наличия населенных пунктов и т.д. Наибольшее количество микроорганизмов содержит воздух больших городов с интенсивным уличным движением,меньше всего микробов в воздухе лесов,гор, но по мере подъема вверх воздух становится все более чистым даже над крупными промышленными городами. В воздухе закрытых помещений содержится значительное количество микроорганизмов,особенно при большом скоплении людей.
Микробы в воздухе находятся на частичках пыли или влаги в виде аэрозолей. Аэрозолем называют коллоидную систему, состоящую из газообразной среды, например, воздуха, в которой содержатся в состоянии распыления мельчайшие частицы твердого вещества или капельки жидкости. На поверхности частиц находится слой адсорбированного воздуха, наличие газовой среды предох-раняет частицы от смачивания.
Устойчивость дисперсной фазы аэрозоля зависит от величины частиц, их поверхностной энергии и электрического заряда. В кинетике микробного аэрозоля схематически различают 3 фазы:
Крупноядерная Фаза.частицы которой имеют диаметр более 0,1 мм и сравнительно быстро оседают, длительность их пребывания в воздухе несколько секунд;
Мелкоядерная Фаза, размер частиц менее 0,1 мм; эти мелкие капельки благодаря большой удельной поверхности и малому весу длительно удерживаются в воздухе, образуя достаточно устойчивую коллоидную систему, микроорганизмы в ней защищены слоем влаги;
Фаза бактериальной пыли. Капли крупноядерной и мелкоядерной фазы аэрозоля, постепенно оседая и высыхая, могут превращаться в так называемую бактериальную пыль, размер частиц которой от I мкм до 100 мкм, частицы бактериальной пыли долго находятся в" воздухе во взвешенном состоянии и могут проникать в верхние дыхательные пути и легкие человека.
В воздухе в естественных условиях встречается до 100 видов различных микроорганизмов, большинство из которых представлено сапрофитами.
К наиболее часто находимым в открытом воздухе микробам относятся различные кокки, спорообразугащие палочки в виде спор (Bacilluc nesentericus ,3;.с.subtilis, Lao .mecateriui.i),
неспорообразующие пигментные бактерии (serrc.tia narcescono)., многочисленные споры грибов ИЗ родов Fenicilliuia,..s;-)ergillus,;.Д1С дрожжи и дрожжеподобные грибы. Наиболее устойчивы к неблагоприятным факторам, действующим в атмосфере, пигментные микроэр- ганизмы, относящиеся к различным систематическим группам.
В воздух, особенно закрытых помещений, от человека и животных могут попадать условно-патогенные и патогенные микроорганизмы: стафилококки, стрептококки, пневмококки, дифтерийные и туберкулезные палочки, вирусы гриппа, ветряной оспы, кори, паро-тита и др. Особенно много микроорганизмов попадает в воздух при кашле, чихании, разговоре; даже совершенно здоровый человек при каждом акте чихания выделяет в окружающую среду приблизительно 10 ООО - 20 ООО микроорганизмов. В распространении многих инфекционных заболеваний так называемых аэрогенных, например, гриппа, ветряной оспы и до., большое значение имеет воздушно-капельный путь передачи. В тех случаях, когда высыхание капель слюны или мокроты приводит, к образованию капельных ядрышек, в которых микробы защищены белковой пленкой, последние могут сохраняться жизнеспособными длительное время. Так, дифтерийные палочки сохраняются сутки, гемолитические стрептококки до 2-х суток, туберкулезные микробактерии до 18 суток. Для профилактики инфекций, для контроля воздуха цехов предприятий медицинской промышленности, учреждений здравоохранения и других целей широко используется санитарно-бактериологическое исследование воздуха. Оно включает определение общего числа микроорганиз-
О
мов в Т м(1000 л) воздуха, т.е. микробного числа воздуха и санитарно-показательных микробов.
Методы микробиологического исследования воздуха подразделяют на седиментационные и фильтрационные.
Разновидностью седиментационного метода является метод ударной струи воздуха. Наиболее простым является седимента- ционный метод Коха: стерильные чашки Петри с МПА открывают в
местах отбора проб воздуха и выдерживают в течение определенного времени (чаще всего от 5 минут до 30 минут), после чего закрывают и помещают в термостат при 37° на 24 часа, а затем оставляют на сутки при комнатной температуре. Микроорганизмы, содержащиеся на частицах аэрозоля оседают на питательную среду и образуют на ней колонии. По количеству выросших колоний подсчитывают микробное число воздуха, пользуясь правилом Омелянского, в соответствии с которым считают, что на поверхность питательной среды площадью 100 см2 в течение 5 минут оседает столько микроорганизмов, сколько их содержится в 3 л воздуха. Зная количество выросших колоний и время экспозиции, вычисляют количество микробов, содержащихся в I (1000 л) воздуха.
Метод Коха при своей простоте и удобстве имеет ряд недостатков: прежде всего, на агар оседают лишь сравнительно крупные частицы аэрозоля, частицы фазы бактериальной пыли могут длительное время находиться в воздухе во взвешенном состоянии, не осаждаяеь, кроме того на процесс седиментации оказывают влияние направление и сила токов воздуха. Посев методом Коха не
г
дает представления о численности в воздухе риккетсий и вирусов.
Рис.92. Прибор Кротова (общий вид).
6811‘**8
Рис.91. Схема прибора Кротова, ([-цилиндрический корпус;2-основание корпуса;3-электромотор; 4-центробежный вентилятор; 5-восьмилопастная крыльчатка;6-диск;7-пружина; 8-чашка Петри; 9-крышка прибора;10-на- кидные замки;11-диски из плексигласа;Т2-кли- новидная щель;13-разрез- ное кольцо;14-штуцер с диафрагмой;15-выводная трубка.
Более совершенными являются методы инструментального ис-следования воздушной микрофлоры с помощью аппаратов Кротова и импакторов (рис.91,92,93). Прибор Кротова представляет собой цилиндрической формы корпус, закрываемый сверху съемной крышкой, под которой на вращающемся диске устанавливается чашка Петри с МПА, внутри цилиндра помещается электрический мотор, последний, вращаясь со скоростью 4-5 тысяч оборотов в минуту, обеспечивает просасывание воздуха через плексигласовую крышку, имеющую клиновидную щель или отверстия. В результате турбулентного потока воздуха внутри цилиндра вращается диск с чашкой Петри, что обеспечивает равномерное распределение микрофлоры по всей поверхности питательной среды, причем активно засасывается аэрозольные частицы всех трех фаз. Пользуясь ротаметром, который предназначен для определения количества засасываемого воздуха, через прибор пропускают от 50 до 200 литров воздуха. После взятия проб чашки закрывают и помещают в термостат при 37° на 24 часа, а затем на 24 часа при комнатной температуре. Подсчитав количество выросших колоний и зная объем пропущенного воздуха, легко вычислить микробное число.
Рис.93. Схема четырехкаскадного импактора Мея (см.описание в тексте).
Импакторы - приборы, снабженные трубками с коническими соплами - каскадами, через которые просасывается воздух. Перед узким концом каждого сопла помещают приемные пластинки, представляющие собой предметные стекла, смазанные глицерином с физиологическим раствором. Воздух просачивается через трубки с соплами? ударяется о приемные пластинки, микроорганизмы оседают на них. После отбора воздуха предметные стекла вынимают из импакторов и исследуют осевшие микробы либо с помощью микроскопии, либо производят смыв со стекла физиологическим раствором, из которого затем делают высевы на питательные среды.
Фильтрационные методы исследования воздуха основаны на фильтрации или аспирации (просасывании) его через специальные фильтры, жидкости, порошки и т.-д., адсорбирующие микрофлору.
Фильтры, применяемые для анализа воздуха, могут быть нерастворимыми - ватные, бумажные, мембранные, миллипоры, и раст-воримыми - глицерино-желатиновые, из альгината натрия,сахарной
і
пудры
Фильтровальная пластинка из соответствующего материала помещается в аппарат Зейтца и с помощью вакуум насоса через фильтр просасывают определенное количество воздуха. Затем фильтровальную пластинку извлекают, погружают в физиологический раствор и встряхивают, микроорганизмы десорбируются в раствор и из него делают количественные высевы на питательные среды. Если в качестве фильтров используют растворимые материалы, то после просасывания воздуха их растворяют в стерильном физиологическом растворе.
Воздух можно просасывать через стерильную жидкость (воду, физиологический раствор, мясопептонный бульон и т.д.), пользуясь прибором Дьяконова (рис.94)
(г
t
VT
Рис.94. Прибор Дьяконова,
Этот прибор состоит из стеклянного цилиндра емкостью 100-200 мл, в герметически закрытую пробку которого вставлена две стеклянные трубки, длинная приводящая трубка заканчивает- ся у самого дна, а отводящая (короткая) непосредственно под пробкой. При исследовании воздуха в прибор заливают 10-20 мл воды, помещают стеклянные бусы и стерилизуют. После стерилизации отводящую трубку соединяют с вакуум-насосом, к которому присоединен реометр для измерения объема воздуха, проходящего через прибор, и просасывают воздух в количестве 100-200 литров. После отключения прибора берут I мл воды, через которую фильт-ровался воздух, вносят в пустую стерильную чашку Петри и заливают 15 мл расплавленного МПА (+ 45°). Чашки с посевами инкубируют в термостате при 37° 1-2 суток, а затем подсчитывают количество выросших колоний и, зная объем профильтрованного воздуха, вычисляют микробное число.
В воздухе закрытых помещений, так же как и в воде и почве определяют наличие санитарно-показательных микроорганизмов.
Ими признаны Streptococcus viridans ,(зеленящий стрептококк) (тип Л.), Str.haemolyticus (гемолитический стрептококки Staphylococcus aureus , обладающий гемолитическими свойствами. Наличие этих микробов в воздухе свидетельствует об обсеме- ненности его микрофлорой верхних дыхательных путей человека. Количество санитарно-показательных микроорганизмов, содержа-
О
щееся в I м (1000 литров) воздуха, называется стрептококковыминдексом.
Для выявления санитарно-показательных микробов воздуха используются все описанные выше методы, но посев производится на элективные и дифференциально-диагностические среды, позволяющие быстро обнаружить эти бактерии и отделить их от других представителей воздушной микрофлоры. К таким средам относится кровяной агар, на котором гемолитические стафилококки и стрептококки дают зону гемолиза (разрушения эритроцитов).желточносолевой агар и др.
Результаты оценки воздуха в жилых помещениях зимой и летом представлены в таблице 10.
Таблица 10
Критерий для санитарной оценки воздуха жилых помещений
О
(число микроорганизмов в I м воздуха) Оценка воздуха Летний период Зимний период всего зеленящего и микро- гемолитического орга- стрептококков низмов всего
микро-
орга
низмов зеленящего и гемолитическо го стрептокок ков Чистый 1500 16 4500 36 Загрязненный.... 2500 36 7000 124 Цель работы: определить микробное число воздуха и содержание санитарно-показательных микроорганизмов.
Материалы: чашки Петри с МПА, сусло-агаром и кровяным агаром, аппарат Кротова.
Ход работы. I. Определить микробное число методом Коха: чашки Петри с МПА, кровяным агаром и сусло-агаром оставить открытыми в разных частях лаборатории на 5 мин. Закрыть чашки и поместить их в термостат при 37°С на 48 часов. Подсчитать число выросших колоний, определить микробное число воздуха (см.выше).
Определить микробное число и количество санитарно-пока-зательных микроорганизмов с помощью аппарата Кротова. Использовать чашки с МПА, кровяным агаром и сусло-агаром. Для каждой
чашки пропустить по 200 л воздуха со скоростью 20-30 л/мин. После взятия проб чашки закрыть и поместить в термостат при 37° на 48 часов. Подсчитать выросшие колонии, промикроскопиро- вать их, приготовив мазки и окрасив их по Граму. Отметить наличие зон гемолиза на кровяном агаре.
Сравнить результаты, полученные двумя методами. Дать оценку чистоты воздуха. Результаты оформить в виде таблицы.
Санитарная оценка воздуха
Среда Число колоний на чашке при определении
методом Коха в аппарате Кротова
МПА
кровяной агар сусло-агар
Микробное число
Число зеленящего и
гемолитического
стрептококков
Литература
ЛабинскаяА.С. Микробиология с техникой микробиологических исследований. М.,1972.
Перети Л.Г. Значение нормальной микрофлоры для организма человека. Медгиз.,1955.
П я т к и н К.Д., КривошеинB.C. Микробиология.М. ,1980. Санитарная микробиология. Под ред. Г. П. Калины и Г.К.Чис- .товича. М.,1969.
Теп В.И. Санитарная микробиология. 1958.
Т и м а к о в В.Д. Микробиология. М.,1973. .
В начале 60-х годов В. Ф. Кротов разработал новый метод решения вариационых задач, который основан на достаточном условии оптимальности, названном впоследствии принципом оптимальности Кротова . Но прежде чем познакомиться с этим принципом, рассмотрим более общую постановку задачи оптимального управления.
Решение задачи оптимального управления в классе кусочно-непрерывных управлений и кусочно-гладких траекторий не всегда существует. Целесообразно обобщить ее так, чтобы расширить класс задач оптимального управления, обладающих решением.
Пусть объект, ограничения и краевые условия задаются следующим образом:
Здесь при каждом фиксированном является некоторым множеством пространства . Обозначим через множество пар кусочно-непрерывных функций и кусочно-гладких (непрерывных и кусочно-дифференцируемых) функций определенных на и удовлетворяющих уравнению на этом интервале, за исключением конечного числа точек, ограничению на всем интервале и краевым условиям (10.70). Множество называют допустимым
множеством, а его элементы - допустимыми парами, а множестве задан функционал

Требуется найти последовательность допустимых пар на которой функционал (10.71) стремится к своему наименьшему значению на множестве
Такая последовательность называется минимизирующей. Последовательность допустимых пар будем также называть допустимой последовательностью.
Основным обобщающим моментом в новой постановке является то, что в качестве решения задачи оптимального управления принимается минимизирующая последовательность, а не определенная допустимая пара. В частном случае, когда существует допустимая пара доставляющая минимум функционалу (10.71), все члены минимизирующей последовательности равны этой паре: .
Пример 10.12. Рассмотрим несколько видоизмененный пример Больца 11]:

Наименьшее значение (точная нижняя грань) функционала равно нулю и достигается на последовательности