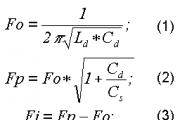Молярный объем газа. Молярная масса и молярный объем вещества
Цель урока: сформировать понятие о молярном, миллимолярном и киломолярном объемах газов и единицах их измерения.
Задачи урока:
- Обучающие – закрепить ранее изученные формулы и найти связь между объемом и массой, количеством вещества и числом молекул, закрепить и систематизировать знания учащихся.
- Развивающие – развивать умения и навыки решать задачи, способности к логическому мышлению, расширять кругозор учащихся, их творческие способности, умения работать с дополнительной литературой, долговременную память, интерес к предмету.
- Воспитательные – воспитывать личности с высоким уровнем культуры, формировать потребность в познавательной деятельности.
Тип урока: Комбинированный урок.
Оборудование и реактивы: Таблица «Молярный объем газов», портрет Авогадро, мензурка, вода, мерные стаканы с серой, оксидом кальция, глюкозы количеством вещества 1 моль.
План урока :
- Организационный момент (1 мин.)
- Проверка знаний в виде фронтального опроса (10 мин.)
- Заполнение таблицы (5 мин.)
- Объяснение нового материала (10 мин.)
- Закрепление (10 мин.)
- Подведение итогов (3 мин.)
- Домашнее задание (1 мин.)
Ход урока
1. Организационный момент.
2. Фронтальная беседа по вопросам.
Как называется масса 1 моля вещества?
Как связать молярную массу и количество вещества?
Чему равно число Авогадро?
Как связано число Авогадро и количество вещества?
А как связать массу и число молекул вещества?
3. А теперь заполните таблицу, решив задачи – это групповая работа.
| Формула, вещества | Масса, г | Молярная масса, г/моль | Количество вещества, моль | Число молекул | Число Авогадро, молекул/моль |
| ZnO | ? | 81 г/моль | ? моль | 18 10 23 молекул | 6 10 23 |
| MgS | 5,6г | 56 г/моль | ? моль | ? | 6 10 23 |
| BaCl 2 | ? | ? г/моль | 0,5 моль | 3 10 23 молекул | 6 10 23 |
4. Изучение нового материала.
«...Мы хотим не только знать, как устроена природа (и как происходят природные явления), но и по возможности достичь цели, может быть, утопической и дерзкой на вид, – узнать, почему природа является именно такой, а не другой. В этом ученые находят наивысшее удовлетворение.»
Альберт Эйнштейн
Итак, наша цель найти наивысшее удовлетворение, как настоящие ученые.
А как называется объем 1 моля вещества?
От чего зависит молярный объем?
Чему будет равен молярный объем воды, если ее M r = 18, а ρ = 1 г/мл?
(Конечно 18 мл).
Для определения объема вы пользовались формулой известной из физики ρ = m / V (г/мл, г/см 3 , кг/м 3)
Отмерим этот объем мерной посудой. Отмерим молярные объемы спирта, серы, железа, сахара. Они разные, т.к. плотность разная, (таблица различных плотностей).
А как обстоит дело у газов? Оказывается, 1 моль любого газа при н.у. (0°С и 760 мм.рт.ст.) занимает один и тот же объем молярный 22,4 л/моль (показывается на таблице). А как будет называться объем 1 киломоля? Киломолярным. Он равен 22,4 м 3 /кмоль. Миллимолярный объем 22,4 мл/моль.
Откуда взялось это число?
Оно вытекает из закона Авогадро. Следствие из закона Авогадро: 1 моль любого газа при н.у. занимает объем 22,4 л/моль.
Немного о жизни итальянского ученого мы сейчас услышим. (сообщение о жизни Авогадро)
А теперь посмотрим зависимость величин от разных показателей:
| Формула вещества | Агрегатное состояние (при н.у.) | Масса, г | Плотность, г/мл | Объем порций в 1 моль, л | Количество вещества, моль | Зависимость между объемом и количеством вещества |
| NaCl | Твердое | 58,5 | 2160 | 0,027 | 1 | 0,027 |
| H 2 O | Жидкое | 18 | 1000 | 0,018 | 1 | 0,18 |
| O 2 | Газ | 32 | 1,43 | 22,4 | 1 | 22,4 |
| H 2 | Газ | 2 | 0,09 | 22,4 | 1 | 22,4 |
| CO 2 | Газ | 44 | 1,96 | 22,4 | 1 | 22,4 |
| SO 2 | газ | 64 | 2,86 | 22,4 | 1 | 22,4 |
Из сравнения полученных данных сделайте вывод (зависимость между объемом и количеством вещества для всех газообразных веществ (при н.у.) выражается одинаковой величиной, которая называется молярным объемом.)
Обозначается V m и измеряется л/моль и т.д. Выведем формулу для нахождения молярного объема
V m = V/ v , отсюда можно найти количество вещества и объем газа. А теперь вспомним ранее изученные формулы, можно ли их объединить? Можно получить универсальные формулы для расчетов.
m/M = V/V m ;
V/V m = N/Na
5. А теперь закрепим полученные знания с помощью устного счета, чтобы знания через умения стали применятся автоматически, то есть превратились в навыки.
За правильный ответ вы будите получать балл, по количеству баллов получите оценку.
- Назовите формулу водорода?
- Какова его относительная молекулярная масса?
- Какова его молярная масса?
- Сколько молекул водорода будет в каждом случае?
- Какой объем займут при н.у. 3 г H 2 ?
- Сколько будут весить 12 10 23 молекул водорода?
- Какой объем займут эти молекулы в каждом случае?
А теперь решим задачи по группам.
Задача №1
Образец: Какой объем занимает 0,2 моль N 2 при н.у.?
- Какой объем занимают 5 моль O 2 при н.у.?
- Какой объем занимают 2,5 моль H 2 при н.у.?
Задача №2
Образец: Какое количество вещества содержит водород объемом 33,6 л при н.у.?
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- Какое количество вещества содержит кислород объемом 0,224 л при н.у.?
- Какое количество вещества содержит углекислый газ объемом 4,48 л при н.у.?
Задача №3
Образец: Какой объем займут 56 г. газа СО при н.у.?
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- Какой объем займут 8 г. газа O 2 при н.у.?
- Какой объем займут 64 г. газа SO 2 при н.у.?
Задача №4
Образец: В каком объеме содержится 3·10 23 молекул водорода H 2 при н.у.?
Задачи для самостоятельного решения
Решите задачи по приведённому образцу:
- В каком объеме содержится 12,04 ·10 23 молекул водорода СO 2 при н.у.?
- В каком объеме содержится 3,01·10 23 молекул водорода O 2 при н.у.?
Понятие относительной плотности газов следует дать на основании их знаний о плотности тела: D = ρ 1 /ρ 2 , где ρ 1 – плотность первого газа, ρ 2 – плотность второго газа. Вы знаете формулу ρ = m/V. Заменив в этой формуле m на М, а V на V m , получим ρ = М/V m . Тогда относительную плотность можно выразить, используя правую часть последней формулы:
D = ρ 1 /ρ 2 = М 1 /М 2 .
Вывод: относительная плотность газов – число, показывающее, во сколько раз молярная масса одного газа больше молярной массы другого газа.
Например, определите относительную плотность кислорода по воздуху, по водороду.
6. Подведение итогов.
Решите задачи для закрепления:
Найдите массу (н.у.): а) 6 л. О 3 ; б) 14 л. газа H 2 S?
Какой объём водорода при н.у. образуется при взаимодействии 0,23 г натрия с водой?
Какова молярная масса газа, если 1 л. его имеет массу 3,17 г.? (Подсказка! m = ρ·V)
Часть I
1. 1 моль любого газа при н. у. занимает одинаковый объём, равный 22,4 л. Этот объём называется молярный и обозначается Vm.
2. Количество вещества (n) - отношение
объёма газа при н. у. к молярному объёму:
n = V/Vm=> Vm измеряется в л/моль.
3. Следовательно, количество вещества
4. Дополните таблицу «Количественные характеристики веществ», делая необходимые вычисления.

Часть II
1. Установите соотношение между названием и размерностью величины.
2. Укажите формулы, которые являются производными от основной формулы n = V/Vm.
2) V=n Vm
3) Vm=V/n
3. Сколько молекул содержат 44,8 л (н. у.) углекислого газа? Решите задачу двумя способами.
4. Придумайте условие задачи, в которой нужно найти число молекул N, если известен объём V.
Найти число частиц оксида азота(II), если его объём равен 67,2 л.
Решите задачу любым способом.
5. Вычислите массу 78,4 л (н. у.) хлора.
6. Найдите объём 297 г фосгена (COCl2).

7. Вычислите массу 56 л аммиака, 10% -й водный раствор которого в медицине известен под названием «нашатырный спирт».
8. Придумайте задачу с использованием изученных понятий. С помощью компьютера создайте рисунок, иллюстрирующий данную задачу. Предложите способ её решения. Верно ли, что 22,4 л азота или 22,4 л водорода одинаковы по массе? Ответ подтвердите вычислениями.
Где m-масса,M-молярная масса, V- объем.
4. Закон Авогадро. Установлен итальянским физиком Авогадро в 1811 г. Одинаковые объемы любых газов, отобранные при одной температуре и одинаковом давлении, содержат одно и тоже число молекул.
Таким образом, можно сформулировать понятие количества вещества: 1 моль вещества содержит число частиц, равное 6,02*10 23 (называемое постоянной Авогадро)
Следствием этого закона является то, что 1 моль любого газа занимает при нормальных условиях (Р 0 =101,3кПа и Т 0 =298К) объём, равный 22,4л.
5. Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
6. Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const.
7. Зависимость между объемом газа, давлением и температурой можно выразить объединенным законом Бойля-Мариотта и Гей-Люссака, которым пользуются для приведения объемов газа от одних условий к другим:
P 0 , V 0 ,T 0 -давление объема и температуры при нормальных условиях: P 0 =760 мм рт. ст. или 101,3 кПа; T 0 =273 К (0 0 С)
8. Независимая оценка значения молекулярноймассы М может быть выполнена с использованием так называемого уравнения состояния идеального газа или уравнения Клапейрона-Менделеева :
pV=(m/M)*RT=vRT. (1.1)
где р - давление газа в замкнутой системе, V - объем системы, т - масса газа, Т - абсолютная температура, R - универсальная газовая постоянная.
Отметим, что значение постоянной R может быть получено подстановкой величин, характеризующих один моль газа при н.у., в уравнение (1.1):
r = (р V)/(Т)=(101,325кПа 22.4 л)/(1 моль 273К)=8.31Дж/моль.К)
Примеры решения задач
Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4×10 -3 м 3 газа, находящиеся при 50 0 С и давлении 0,954×10 5 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака:
pV/T = p 0 V 0 /T 0 .
Объем газа (н.у.) равен, где Т 0 = 273 К; р 0 = 1,013×10 5 Па; Т = 273 + 50 = 323 К;
М 3 = 0,32×10 -3 м 3 .
При (н.у.) газ занимает объем, равный 0,32×10 -3 м 3 .
Пример 2. Вычисление относительной плотности газа по его молекулярной массе.
Вычислите плотность этана С 2 Н 6 по водороду и воздуху.
Решение. Из закона Авогадро вытекает, что относительная плотность одного газа по другому равна отношению молекулярных масс (М ч ) этих газов, т.е. D=М 1 /М 2 . Если М 1 С2Н6 = 30, М 2 Н2 = 2, средняя молекулярная масса воздуха равна 29, то относительная плотность этана по водороду равна D Н2 = 30/2 =15.
Относительная плотность этана по воздуху: D возд = 30/29 = 1,03, т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Пример 3. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей из 80 % метана и 20 % кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газовой смеси по водороду через D Н2 . она будет больше плотности метана, но меньше плотности кислорода:
80D Н2 – 640 = 320 – 20D Н2 ; D Н2 = 9,6.
Плотность этой смеси газов по водороду равна 9,6. средняя молекулярная масса газовой смеси М Н2 = 2D Н2 = 9,6×2 = 19,2.
Пример 4. Вычисление молярной массы газа.
Масса0,327×10 -3 м 3 газа при 13 0 С и давлении 1,040×10 5 Па равна 0,828×10 -3 кг. Вычислите молярную массу газа.
Решение. Вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона:
где m – масса газа; М – молярная масса газа; R – молярная (универсальная) газовая постоянная, значение которой определяется принятыми единицами измерения.
Если давление измерять в Па, а объем в м 3 , то R =8,3144×10 3 Дж/(кмоль×К).
3.1. При выполнении измерений атмосферного воздуха, воздуха рабочей зоны а также промышленных выбросов и углеводородов в газовых магистралях существует проблема приведения объемов измеряемого воздуха к нормальным (стандартным) условиям. Часто на практике при проведении измерений качества воздуха не используется пересчет измеренных концентраций к нормальным условиям, в результате чего получаются недостоверные результаты.
Приведем выдержку из Стандарта:
«Измерения приводят к стандартным условиям, используя следующую формулу:
С 0 = C 1 * Р 0 Т 1 / Р 1 Т 0
где: С 0 - результат, выраженный в единицах массы на единицу объема воздуха, кг /куб. м, или количества вещества на единицу объема воздуха, моль/куб. м, при стандартных температуре и давлении;
С 1 - результат, выраженный в единицах массы на единицу объема воздуха, кг /куб. м, или количества вещества на единицу объема
воздуха, моль/куб. м, при температуре Т 1 , К, и давлении Р 1 , кПа.»
Формула приведения к нормальным условиям в упрощенном виде имеет вид (2)
С 1 = С 0 * f , где f = Р 1 Т 0 / Р 0 Т 1
стандартный пересчетный коэффициент приведения к нормальным условиям. Параметры воздуха и примесей измеряют при разных значениях температуры, давления и влажности. Результаты приводят к стандартным условиям для сравнения измеренных параметров качества воздуха в различных местах и различных климатических условиях.
3.2.Отраслевые нормальные условия
Нормальные условия это стандартные физические условия, с которыми обычно соотносят свойства веществ (Standard temperature and pressure, STP). Нормальные условия определены IUPAC (Международным союзом практической и прикладной химии) следующим образом: Атмосферное давление 101325 Па = 760 мм рт.ст.. Температура воздуха 273,15 K = 0° C.
Стандартные условия (Standard Ambient Temperature and Pressure, SATP) это нормальные окружающие температура и давление: давление 1 Бар = 10 5 Па = 750,06 мм Т. ст.; температура 298,15 К = 25 °С.
Другие области.
Измерения качества воздуха.
Результаты измерений концентраций вредных веществ в воздухе рабочей зоны приводят к условиям: температуре 293 К (20°С) и давлению 101,3 кПа (760 мм рт. ст.).
Аэродинамические параметры выбросов загрязняющих веществ должны измеряться в соответствии с действующими государственными стандартами. Объемы отходящих газов, полученные по результатам инструментальных измерений, должны быть приведены к нормальным условиям (н.у.): 0°С, 101,3 кПа..
Авиация.
Международная организация гражданской авиации (ICAO) определяет международную стандартную атмосферу (International Standard Atmosphere,ISA) на уровне моря с температурой 15 °C, атмосферным давлением 101325 Па и относительной влажностью 0 %. Эти параметры используется при расчётах движения летательных аппаратов.
Газовое хозяйство.
Газовая отрасль Российской Федерации при расчётах с потребителями использует атмосферные условия по ГОСТ 2939-63:температура 20°С (293,15К); давление 760 мм рт. ст. (101325 Н/м²); влажность равна 0. Таким образом, масса кубометра газа по ГОСТ 2939-63 несколько меньше, чем при «химических» нормальных условиях.
Испытания
Для проведения испытаний машин, приборов и других технических изделий за нормальные значения климатических факторов при испытаниях изделий (нормальные климатические условия испытаний) принимают следующие:
Температура - плюс 25°±10°С; Относительная влажность – 45-80%
Атмосферное давление 84-106 кПа (630-800 мм. рт. ст.)
Поверка измерительных приборов
Номинальные значения наиболее распространенных нормальных влияющих величин выбираются следующие: Температура – 293 К (20°С), атмосферное давление - 101,3 кПа (760 мм рт. ст.).
Нормирование
В методических указаниях, касающихся установления норм качества воздуха, указывается, что ПДК в атмосферном воздухе устанавливаются при нормальных условиях в помещении, т.е. 20 С и 760 мм. рт. ст.
P1V1=P2V2, или, что то же самое, PV=const (закон Бойля-Мариотта). При постоянном давлении постоянным остается отношение объема к температуре: V/T=const (закон Гей-Люссака). Если же зафиксировать объем, то P/T=const (закон Шарля). Объединение этих трех законов дает универсальный закон, который гласит, что PV/T=const. Данное уравнение было установлено французским физиком Б. Клапейроном в 1834 году.
Значение постоянной определяется лишь количеством вещества газа . Д.И. Менделеев в 1874 году вывел уравнение для одного моля. Так он значение универсальной постоянной: R=8,314 Дж/(моль∙К). Итак, PV=RT. В случае произвольного количества газа ν PV=νRT. Само количество вещества можно найти из массы к молярной массе: ν=m/M.
Молярная масса численно равна относительной молекулярной. Последнюю можно найти из таблицы Менделеева, она указывается в ячейке элемента, как правило, . Молекулярная масса равна сумме молекулярных масс входящих в него элементов. В случае разновалентных атомов требуется на индекс. Напри мер, M(N2O)=14∙2+16=28+16=44 г/моль.
Нормальными условиями для газов при нято считать P0 =1 атм = 101, 325 кПа, температуру T0=273,15 К = 0°C. Теперь можно найти объем одного моля газа при нормальных условиях : Vm=RT/P0=8,314∙273,15/101,325=22,413 л/моль. Эта табличная величина является молярным объемом.
При нормальных условиях количество отношению объема газа к молярному объему: ν=V/Vm. При произвольных условиях надо использовать непосредственно уравнение Менделеева-Клапейрона: ν=PV/RT.
Таким образом, чтобы найти объем газа при нормальных условиях , надо количество вещества (число молей) этого газа умножить на молярный объем, равный 22,4 л/моль. Обратной операцией можно найти количество вещества из заданного объема.
Чтобы найти объем одного моля вещества в твердом или жидком состоянии, найдите его молярную массу и поделите на плотность. Один моль любого газа в нормальных условиях имеет объем 22,4 л. В том случае если условия изменяются, рассчитайте объем одного моля при помощи уравнения Клапейрона-Менделеева.
Вам понадобится
- периодическая таблица Менделеева, таблица плотности веществ, манометр и термометр.
Инструкция
Определение объема одного моля или твердого тела
Определите химическую формулу твердого тела или жидкости, которая изучается. Затем, с помощью периодической таблицы Менделеева найдите атомные массы элементов, которые входят в формулу. Если один в формулу несколько раз, умножьте его атомную массу на это число. Сложите атомные массы и получите молекулярную массу , из которого состоит твердое тело или жидкость. Она будет численно равна молярной массе, измеренной в граммах на моль.
По таблице плотности веществ найдите эту величину для материала изучаемого тела или жидкости. После этого поделите молярную массу на плотность данного вещества, измеренную в г/см³ V=M/ρ. В результате получите объем одного моля в см³. Если вещества осталась неизвестной, определить объем одного его моля будет невозможно.
^ Молярная масса и молярный объем вещества. Молярная масса – масса моля вещества. Она рассчитывается через массу и количество вещества по формуле:Мв = К· Мr (1)
Где: К – коэффициент пропорциональности, равный 1г/моль.
В самом деле, для изотопа углерода 12 6 С Аr = 12, а молярная масса атомов (по определению понятия «моль») равна 12г/моль. Следовательно, численные значения двух масс совпадают, а значит, К = 1. Отсюда следует, что молярная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная (атомная) масса. Так, молярная масса атомарного водорода равна 1,008г/моль, молекулярного водорода – 2,016г/моль, молекулярного кислорода – 31,999г/моль.
Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц. Отсюда следует, что при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Отношение объема, занимаемого веществом, к его к его количеству называется молярным объемом вещества. При нормальных условиях (101,325 кПа; 273 К) молярный объем любого газа равен 22,4 л/моль (точнее, Vn = 22,4 л/моль). Это утверждение справедливо для такого газа, когда другими видами взаимодействия его молекул между собой, кроме их упругого столкновения, можно пренебречь. Такие газы называют идеальными. Для неидеальных газов, называемых реальными, молярные объемы различны и несколько отличаются от точного значения. Однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах.
Измерения объемов газа обычно проводят при условиях, отличных от нормальных. Для приведения объема газа к нормальным условиям можно пользоваться уравнением, объединяющим газовые законы Бойля – Мариотта и Гей – Люссака:
pV / T = p 0 V 0 / T 0
Где: V – объем газа при давлении p и температуре T;
V 0 – объем газа при нормальном давлении p 0 (101,325 кПа) и температуре T 0 (273,15 К).
Молярные массы газов можно вычислить также, пользуясь уравнением состояния идеального газа – уравнением Клапейрона – Менделеева:
pV = m B RT / M B ,
Где: p – давление газа, Па;
V – его объем, м 3 ;
M B - масса вещества, г;
M B – его молярная масса, г/моль;
Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж / (моль·К).
Если объем и давление газа выражены в других единицах измерения, то значение газовой постоянной в уравнении Клапейрона – Менделеева примет другое значение. Оно может быть рассчитано по формуле, вытекающей из объединенного закона газового состояния для моля вещества при нормальных условиях для одного моля газа:
R = (p 0 · V 0 / T 0)
Пример 1. Выразите в молях: а) 6,0210 21 молекул СО 2 ; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна молярная масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определённого сорта, равное постоянной Авогадро. Отсюда, а) 6,0210 21 т.е. 0,01 моль; б) 1,2010 24 , т.е. 2 моль; в) 2,0010 23 , т.е. 1 / 3 моль. Масса моля вещества выражается в кг/моль или г/моль. Молярная масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.)
Так как молекулярные массы СО 2 и Н 2 О и атомная масса кислорода соответственно равны 44; 18 и 16а.е.м.,то их молярные массы равны: а) 44г/моль; б) 18г/моль; в)16г/моль.
Пример 2. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см. пример 1) содержит постоянную Авогадро N A структурных единиц (в нашем примере молекул). Молярная масса H 2 SO 4 равна 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02 10 23) = 1,63 10 -22 г.
Моля́рный объём - объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул.
Значение N A = 6,022…×10 23 называется числом Авогадро в честь итальянского химика Амедео Авогадро. Это универсальная постоянная для мельчайших частиц любого вещества.
Именно такое количество молекул содержит 1 моль кислорода О 2 , такое же количество атомов в 1 моле железа (Fe), молекул в 1 моле воды H 2 O и т. д.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях имеет один и тот же объём V m = 22,413 996(39) л . При нормальных условиях большинство газов близки к идеальным, поэтому вся справочная информация о молярном объёме химических элементов относится к их конденсированным фазам, если не оговорено обратно