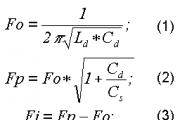Аллотропные модификации серы. Аллотропные формы серы
Дата _____________ Класс ___________________
Тема: Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы.
Цели урока:
рассмотреть вещество «сера», аллотропию серы, ознакомиться с физическими и химическими свойствами серы.
Ход урока
1. Организационный момент урока. 2. Изучение нового материалаCера в природе
Самородная сера Украина, Поволжье, Центральная Азия и др Сульфиды PbS - свинцовый блеск Cu 2 S – медный блеск ZnS – цинковая обманка FeS 2 – пирит, серный колчедан, кошачье золото H 2 S – сероводород (в минеральных источниках и природном газе) Белки Волосы, кожные покровы, ногти… Сульфаты CaSO 4 x 2H 2 O - гипс MgSO 4 x 7H 2 O – горькая соль (английская) Na 2 SO 4 x 10H 2 O – глауберова соль (мирабилит)Физические свойства
Твердое кристаллическое вещество , нерастворима в воде, водой не смачивается (плавает на поверхности), t ° кип = 445°САллотропия
Для серы характерны несколько аллотропных модификаций:Ромбическая (a - сера) - S 8
t ° пл. = 113° C; ρ= 2,07 г/см 3 . Наиболее устойчивая модификация.
Строение атома серы
Размещение электронов по уровням и подуровнямПолучение серы
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2 H 2 S + O 2 = 2 S + 2 H 2 O3. Реакция Вакенродера 2 H 2 S+ SO 2 = 3 S+ 2 H 2 OХимические свойства серы
Сера - окислитель
S 0 + 2ē S -2
Применение Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д. 3. Закрепление изученного материала №1. Закончите уравнения реакций:S + O 2
S + Na
S + H 2
Расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
№2. Осуществите превращения по схеме:
H 2 S → S → Al 2 S 3 → Al(OH) 3
№3.
Закончите уравнения реакций, укажите, какие свойства проявляет сера (окислителя или восстановителя):
Al
+
S= (при нагревании)
S
+
H 2
= (150-200)
S
+
O 2
= (при нагревании)
S
+
F 2
=
(при обычных условиях)
S + H
2 SO 4 (к
) =S + KOH =
S + HNO 3 =4. Это интересно...
- Содержание серы в организме человека массой 70 кг - 140 г.
В сутки человеку необходимо 1 г серы.
Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Соединения серы могут служить лекарственными препаратами;
Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
Железный купорос FeSO4×7H2O используют при анемии.
BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
Алюмокалиевые квасцы KAI(SO4) 2×12H2O - кровоостанавливающее средство при порезах.
Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р. Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Сера - одно из немногих веществ, которое было известно с древнейших времен, её использовали первые химики. Одна из причин известности серы - распространенность самородной серы в странах древнейших цивилизаций. Её разрабатывали греки и римляне, производство серы значительно увеличилось после изобретения пороха.
Сера расположена в 16 группе Периодической системы химических элементов Менделеева .
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s 2 3p 4 . В соединениях с металлами сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами - положительные +2, +4, +6. Сера - типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,0048 %. Значительная часть серы встречается в самородном состоянии.
Также сера встречается в форме сульфидов : пирит, халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен C 4 H 4 S, органические сульфиды) и нефтяных газах (сероводород).
Существование аллотропных модификаций серы связано с её способностью образовывать устойчивые гомоцепи - S - S -. Устойчивость цепей объясняется тем, что связи - S - S - оказываются прочнее, чем связь в молекуле S 2 . Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикулярных р-орбиталей.
Существует три аллотропные модификации серы: ромбическая, моноклинная и пластическая. Ромбическая и моноклинная модификации построены из циклических молекул S 8 , размещенных по узлам ромбической и моноклинной решеток.
Молекула S 8 имеет форму короны, длины всех связей - S - S - равны 0,206 нм и углы близки к тетраэдрическим 108°.
В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда, а в случае моноклинной серы элементарный объем выделяется в виде скошенного параллелепипеда.
Кристалл ромбической серы. Кристалл моноклинной серы
Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно-желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера - резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.
Аллотропия (от др.-греч. αλλος «другой», τροπος «поворот, свойство») существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.

Сера имеет три аллотропных модификации Ромбическа я Ромбическа я Пластическая Моноклинная При комнатной температуре устойчива ромбическая сера. При нагревании она плавится, превращаясь в желтую легкоподвижную жидкость, при дальнейшем нагревании жидкость загустевает, так как в ней образуются длинные полимерные цепочки. При медленном охлаждении расплава образуются темно- желтые игольчатые кристаллы моноклинной серы, а если вылить расплавленную серу в холодную воду, получится пластическая сера – резиноподобная структура, состоящая из полимерных цепочек. Пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в ромбическую.


Ромбическая модификация серы Молекула S 8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°. В ромбической сере наименьший элементарный объем имеет форму прямоугольного параллелепипеда. Ромбическая сера - жёлтого цвета. Кристалл ромбической серы


Моноклинная модификация серы Моноклинная сера плавится при 119, 3 С. Расплавленная сера состоит главным образом из циклических молекул S8 и представляет собой подвижную желтую жидкость. При нагревании расплава до температур выше 160 С циклы S8 размыкаются, образуя длинные многоатомные цепи, расплав постепенно теряет текучесть и меняет цвет: из желтого становится темно-коричневым. При температурах выше 187 С цепи разрываются и укорачиваются, вязкость расплавленной серы уменьшается. Моноклиническая сера- бледно-жёлтого цвета.


Пластическая модификация серы Если расплавленную серу вылить в холодную воду, образуется похожая на резину коричневая масса. Это третья аллотропная модификация серы - пластическая сера. Она состоит из нерегулярно расположенных зигзагообразных цепочек S n, где n достигает нескольких тысяч. Она неустойчива и через некоторое время станет хрупкой, приобретёт жёлтый цвет, т.е. постепенно будет превращаться в ромбическую.

Это понятие широко распространено в природе. К примеру, кислород и озон - это вещества, состоящие только из химического элемента оксигена. Как это возможно? Давайте разбираться вместе.
Определение понятия
Аллотропией называют явление существования одного химического элемента в виде двух или более простых веществ. Его открывателем по праву считается химик и минеролог из Швеции Йенс Берцелиус. Аллотропия - это явление, которое имеет много общего с полиморфизмом кристаллов. Это вызвало долгие споры среди ученых. В настоящее время они пришли к мнению, что полиморфизм характерен только для твердых простых веществ.
Причины аллотропии
Образовывать несколько простых веществ могут не все химические элементы. Способность к аллотропии обусловлена строением атома. Чаще всего она встречается у элементов, имеющих переменное значение степени окисления. К ним относятся полу- и неметаллы, инертные газы и галогены.
Аллотропия может быть обусловлена несколькими причинами. К ним относится разное количество атомов, порядок их соединения в молекулу, параллельность спинов электронов, тип кристаллической решетки. Рассмотрим данные виды аллотропии на конкретных примерах.
Кислород и озон
Данный вид аллотропии - пример того, как разное количество атомов одного химического элемента определяет физические и химические Это касается и физиологического влияния на живые организмы. Так, кислород состоит из двух атомов оксигена, озон - из трех.
В чем же отличия этих веществ? Оба они газообразны. Кислород не имеет цвета, вкуса и запаха, он в полтора раза легче озона. Это вещество хорошо растворяется в воде, причем с понижением температуры скорость этого процесса только увеличивается. Кислород необходим всем организмам для дыхания. Поэтому это вещество является жизненно важным.
Озон имеет голубой цвет. Его характерный запах ощущал каждый из нас после дождя. Он резкий, но довольно приятный. По сравнению с кислородом, озон более химически активен. В чем же причина? При разложении озона образуется молекула кислорода и свободный атом оксигена. Он тут же вступает в образуя новые вещества.
Удивительные свойства углерода
А вот количество атомов в молекуле углерода всегда остается неизменным. При этом он образует абсолютно разные вещества. Самыми распространенными модификациями углерода являются алмаз и графит. Первое вещество считается самым твердым на планете. Это свойство обусловлено тем, что атомы в алмазе связаны прочными ковалентными связями по всем направлениям. В совокупности они образуют трехмерную сеть из тетраэдров.

У графита прочные связи формируются только между атомами, расположенными в горизонтальной плоскости. По этой причине разломать графитовый стержень вдоль практически невозможно. А вот связи, которые соединяют горизонтальные слои углерода между собой, очень слабые. Поэтому каждый раз, когда мы проводим простым карандашом по бумаге, на ней остается серый след. Это и есть слой углерода.
Аллотропия серы
Причина модификаций серы также заключается в особенностях внутренней структуры молекул. Самой устойчивой формой является ромбическая. Кристаллы этого вида аллотропии серы называют ромбоидальными. Каждый из них образован коронообразными молекулами, в состав каждой из которой входит 8 атомов. По физическим свойствам ромбическая сера является твердым веществом желтого цвета. Она не только не растворяется в воде, но даже не смачивается ею. Показатели тепло- и электропроводности очень низкие.

Структура моноклинной серы представлена параллелепипедом со скошенными углами. вещество напоминает иглы темно-желтого цвета. Если серу расплавить, а потом поместить в холодную воду, образуется ее новая модификация. Ее первоначальная структура разрушится до полимерных цепей разной длины. Так получают пластическую серу - резиноподобную массу коричневого цвета.
Модификации фосфора
Ученые насчитывают 11 видов фосфора. Его аллотропия была открыта практически случайно, как и само это вещество. В поисках философского камня алхимик Бранд получил светящуюся сухую субстанцию в результате выпаривания мочи. Это был белый фосфор. Данное вещество характеризуется большой химической активностью. Достаточно повышения температуры до 40 градусов, чтобы белый фосфор вступил в реакцию с кислородом и воспламенился.

Для фосфора причина аллотропии - это изменение в структуре кристаллической решетки. Изменить ее можно только при определенных условиях. Так, увеличив давление и температуру в атмосфере углекислого газа, получают красный фосфор. Химически он менее активен, поэтому для него не характерно свечение. При нагревании он превращается в пар. Мы наблюдаем это каждый раз, зажигая обычные спички. Терочная поверхность как раз содержит красный фосфор.
Итак, аллотропия - одного химического элемента в виде нескольких простых веществ. Чаще всего встречается среди неметаллов. Основными причинами этого явления считаются разное количество атомов, образующих молекулу вещества, а также изменение конфигурации кристаллической решетки.
Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
| ПОДГРУППА КИСЛОРОДА (ХАЛЬКОГЕНЫ)
В подгруппу кислорода входят элементы: кислород, сера, селен, теллур, полоний.
ХАЛЬКОГЕНЫ В ПРИРОДЕ
Положение в таблице
Свойства элементов VI-A подгруппы.
Кислород и сера имеют одинаковое строение внешнего энергетического уровня –ns 2 np 4 , где n – номер периода. Кислород O 2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе. |
АЛЛОТРОПИЯ КИСЛОРОДА
Строение атома
Химические свойства
Взаимодействие веществ с кислородом называется окислением .
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
С неметаллами
S + O 2 → SO 2
2H 2 + O 2 → 2H 2 O
С металлами
2Mg + O 2 → 2MgO
2Cu + O 2 →2CuO (при нагревании)
Со сложными веществами
4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
2H 2 S + 3O 2 → 2SO 2 + 2H 2 O
CH 4 + 2O 2 →CO 2 + 2H 2 O
Горение в кислороде
2. Действием серной кислоты на пероксид бария
3BaO 2 + 3H 2 SO 4 → 3BaSO 4 + 3H 2 O + O 3
Получение и обнаружение озона
Химические свойства
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами.
O 3 → O 2 + O (озон неустойчив)
Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
6Ag + O 3 → 3Ag 2 O
Т. е. озон - сильный окислитель:
2KI + O 3 + H 2 O → 2KOH + I 2 + O 2
Озон в природе
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы. Озон является постоянным компонентом атмосферы Земли и играет важную роль для поддержания на ней жизни. В приземных слоях земной атмосферы концентрация озона чрезвычайно мала и составляет величину порядка 10-7 - 10-6%. Однако с увеличением высоты концентрация озона резко возрастает, проходя через максимум на высоте 20-30 км. Общее содержание озона в атмосфере может быть охарактеризовано слоем озона, приведённого к нормальным условиям (0°С, 1 атм ), и составляет толщину около 0,4-0,6 см. Общее содержание озона в атмосфере переменное, и колеблется в зависимости от времени года и географической широты. Как правило, концентрация озона больше в высоких широтах и максимальна весной, а минимальна осенью. Известно, что атмосферный озон играет ключевую роль для поддержания жизни на земле, выступая в качестве защитной составляющей для живых организмов от жёсткого ультрафиолетового излучения Солнца. С другой стороны, озон является весьма эффективным парниковым газом, и, поглощая инфракрасное излучение поверхности Земли, препятствует её охлаждению. Установлено, что нахождение и перемещение масс озона в атмосфере Земли существенно влияет на метеорологическую обстановку на планете.
Применение озона обусловлено его свойствами
1. сильного окисляющего агента:
· для стерилизации изделий медицинского назначения
· при получении многих веществ в лабораторной и промышленной практике
· для отбеливания бумаги
· для очистки масел
2. сильного дезинфицирующего средства:
· для очистки воды и воздуха от микроорганизмов (озонирование)
· для дезинфекции помещений и одежды
Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие токсинов после обработки. Тогда как при хлорировании возможно образование существенного количества токсинов и ядов, например, диоксина.
Сера. Аллотропия серы. Физические и химические свойства серы. Применение
| СЕРА S
Cера в природе
Самородная сера
Украина, Поволжье, Центральная Азия и др
Сульфиды
PbS - свинцовый блеск
Cu 2 S – медный блеск
ZnS – цинковая обманка
FeS 2 – пирит, серный колчедан, кошачье золото
H 2 S – сероводород (в минеральных источниках и природном газе)
Белки
Волосы, кожные покровы, ногти…
Сульфаты
CaSO 4 x 2H 2 O - гипс
MgSO 4 x 7H 2 O – горькая соль (английская)
Na 2 SO 4 x 10H 2 O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t° кип = 445°С
Аллотропия
Для серы характерны несколько аллотропных модификаций:
Взаимопревращение аллотропных модификаций серы |
Строение атома серы
Размещение электронов по уровням и подуровням
Получение серы
1. Промышленный метод - выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакция Вакенродера
2H 2 S + SO 2 = 3S + 2H 2 O
Химические свойства серы