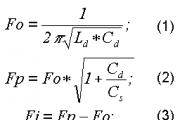Парциальное давление формула. Задачи на нахождение парциального давления газов и общего давления смеси
Парциальным давлением ( p o ) газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси.
Согласно закону: общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
Задачи
1. (Р.77) При н.у. масса 0,5×10 -3 м 3 газа равна 1,806*10× -3 кг. Определите плотность газа по диоксиду углерода СО 2 и метану СН 4 , а также молекулярную массу газа.
Ответ : 1,84, 5,05, 80,9 × 10 -9 кг.
2. (Р.83) Объем резиновой камеры автомобильной шины равен 0,025 м 3 , давление в ней 5,0665 × 10 5 Па. Определите массу воздуха, находящегося в камере, при 20°С.
Ответ : 0,15 кг.
3. (Р.86) Определите массу паров толуола в помещении объемом 30 м 3 при 25°С. Давление паров толуола при этой температуре равно 2972 Па.
Ответ : 3,31 кг.
4. (Р.88) Определите массу 10 -3 м 3 газовой смеси, содержащей (по объему) 50 % водорода и 50 % диоксида углерода (н.у.).
Ответ : 1,02 × 10 -3 кг.
5. (Р.89) Газ (н.у.) занимает объем 1 м 3 . При какой температуре объем газа утроится, если давление газа не меняется?
Ответ : 819 К.
6. (Р.92) Какую массу СаСО 3 надо взять, чтобы получить при его прокаливании диоксид углерода, занимающий объем 25 × 10 -6 м 3 при 15°С и давлении 104000 Па?
Ответ : 0,109 × 10 -3 кг.
7. (Р.94) Из 5 × 10 -3 кг хлората калия КСlО 3 было получено 0,7 × 10 -3 м 3 кислорода, измеренного при 20°С и давлении 111900 Па. Определите массовую долю примесей в хлорате калия.
Ответ : 48 %.
8. (С.1) Будет ли одинаковым количество молекул в равных объемах водорода и кислорода: а) при нормальных условиях; б) при температуре 25°С и давлении 1 атм; в) если условия, при которых измерены объемы водорода и кислорода, различны?
9. (С.9) При какой температуре 1 л хлора будет весить 1 г, если давление равно 1 атм?
Ответ : 863 К.
10. (С.15) Сосуд емкостью 112 л, заполненный воздухом под давлением 1 атм, весит 2,5 кг. Каков будет вес этого сосуда, если его наполнить хлором под давлением 5 атм?
Отве т: 4,13 кг.
11. (С.32) Литр одного газа, взятого при нормальных условиях, весит 1,43 г, второго – 0,09 г. Найдите число молекул во взятых объемах газа. Исключите лишние данные из задачи. Проведите расчет.
Ответ : 2,69 × 10 22 .
12. (С.35) Сколько молекул азота и кислорода будет находиться при нормальных условиях в 896 мл газовой смеси, состоящей по объему 50 % азота и 50 % кислорода? Исключите лишние данные из задачи. Проведите расчет.
Ответ : 2,41 × 10 22 .
13. (С.60) Определите плотность смеси окиси и двуокиси углерода по водороду, если известно, что окись углерода составляет 20 % по объему. Найдите массу 1 л такой смеси при температуре 27°С и давлении 1 атм.
Ответ : 20,4, 1,66 г.
14. (С.68) Объем смеси окиси углерода с кислородом равен 200 мл. После сгорания всей окиси углерода за счет находившегося в смеси кислорода и приведения объемов газов к первоначальным условиям было получено 150 мл новой смеси газов. Определите в процентах объемный состав исходной смеси.
Ответ : 50 %.
15. (С.76) Смесь водорода с азотом, объем которой измерен при определенных условиях, сожгли в избытке кислорода. После окончания реакции и приведения газов к первоначальным условиям (вода сконденсировалась) уменьшение объема газов оказалось равным объему исходной смеси водорода с азотом. Определите объемной соотношение газов в смеси.
Ответ : 2: 1.
16. (С.92) В замкнутом сосуде имеется 100 молей азота и водорода в отношении 1:3. Давление смеси 300 атм. Определите состав и давление смеси после того, как 10 % азота вступили в реакцию и газы приведены к первоначальной температуре.
Ответ : 285 атм.
17. (С.100) В замкнутом сосуде при температуре 0°С находилось 3 л кислорода и 4 л водорода. Как изменится давление в сосуде, если одно из веществ прореагирует полностью, после чего будет восстановлена первоначальная температура?
Ответ : в 7 раз.
18. (П.122) Какой из благородных газов находится в смеси с аммиаком, если известно, что при нормальном давлении и 80°С ее плотность равна 0,5165 г/л?
Ответ : Не.
19. (П.130) В смеси аммиака и азота число атомов в 3,4 раза больше числа молекул. Выясните относительную плотность этой газовой смеси по воздуху.
Ответ : 0,700.
20. (Г.21) Даны 480 л газа при 17°С и 104 кПа. Приведите объем газа к нормальным условиям: 0°С и 101,3 кПа.
Ответ : 464 л.
21. (Г.25) Даны 8 л газа при –23°С. При какой температуре объем газа станет равным 10 л, если давление останется неизменным?
Ответ : 39,5°С.
22. (Г.27) В закрытом баллоне находится газ при температуре –3°С под некоторым давлением. До какой температуры должен быть нагрет газ, чтобы давление внутри баллона выросло на 20 %?
Ответ : 51°С.
23. (Г.41) Баллон вместимостью 10 л содержит при 27°С моль кислорода. Вычислите давление кислорода в баллоне.
Ответ : 249 кПа.
24. (Г.42) В закрытом баллоне вместимостью 40 л находится 77 г СО 2 . Манометр, присоединенный к баллону, показывает давление 106,6 кПа. Вычислите температуру газа.
Ответ : 20,2°С.
25. (Г.56) Из 3 г смеси СаСО 3 и MgCО 3 получено 760 мл СО 2 (при 20°С и 99,7 кПа). Вычислите количественное соотношение СаСО 3 и MgCО 3 .
Ответ : 4:1.
26. (Г.58) Соединение содержит 46,15 % углерода, остальное – азот. Плотность по воздуху равна 1,79. Найдите истинную формулу соединения.
Ответ : C 2 N 2 .
27. (Г.67) При сжигании некоторого соединения азота с водородом полечено из 0,24 г Н 2 О и 168 мл азота (при 0°С и 101,3 кПа). Плотность пара азотсодержащего вещества по воздуху 1,1. Какова истинная формула вещества?
Ответ : N 2 H 4 .
28. (Г.128) Сколько молекул содержится в 1 мл любого газа, измеренного при нормальных условиях (при 0°С и 101,3 кПа)?
Ответ : 2,7 × 10 19 .
29. (Г.136) Сколько лет потребуется для того, счтобы пересчитать число молекул, которое содержится в 1 г воды, если отсчитывать по одной молекуле в секунду? (Считать год равным 365 дням).
Ответ : 1,06 × 10 15 .
30. (Р.96) При 0°С в сосуде объемом 14 × 10 –3 м 3 содержится 0,8 × 10 –3 кг водорода и 6,30 × 10 –3 кг азота. Определите парциальное давление азота и общее давление смеси.
Ответ : 36479,43; 101331,75 Па.
31. (Р.97) В газометре над водой при 20°С и давлении 98500 Па находится 8 × 10 –3 м 3 кислорода. Давление водяного пара при 20°С равно 2335 Па. Какой объем (н.у.) займет кислород, находящийся в газометре?
Ответ : 7,07 × 10 –3 м 3 .
32. (Р.98) Газовая смесь состоит из 5 × 10 –3 м 3 азота, находящегося под давлением 95940 Па, и 3 × 10 –3 м 3 кислорода. Объем смеси 8 × 10 –3 м 3 . Общее давление газовой смеси 104200 Па. Под каким давлением взят кислород?
Ответ : 117967 Па.
33. (Р.99) 0,2 × 10 –3 м 3 водорода собраны над водой при 33°С и давлении 96000 Па. Определите объем сухого водорода (н.у.). упругость насыщенного водяного пара при 33°С равна 5210 Па.
Ответ : 1,59 × 10 –4 м 3 .
34. (Р.100) В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86 % Ar и 14 % N 2 . Рассчитайте парциальное давление каждого из газов, если общее давление равно 39990 Па.
Ответ : 34391,4; 5598,6 Па.
35. (Р.101) Водород объемом 3 × 10 –3 м 3 находится под давлением 100500 Па. Какой объем аргона под таким же давлением надо прибавить к водороду, чтобы при неизменном общем давлении парциальное давление аргона в смеси стало равным 83950 Па?
Ответ : 15,2 × 10 –3 м 3 .
36. (Р.102) Газовая смесь составлена из 5 × 10 –3 м 3 метана под давлением 96000Па, 2 × 10 –3 м 3 водорода под давлением 84000Па и 3 × 10 –3 м 3 диоксида углерода под давлением 109000Па. Объем смеси 8 × 10 –3 м 3 . Определите парциальные давления газов в смеси и общее давление смеси.
Ответ : 60000; 21000; 40875; 121875 Па.
37. (Р.104) Равновесная смесь CO + Cl 2 « COCl 2 , содержащая 0,7 кмоль СО, 0,2 кмоль Cl 2 и 0,5 кмоль COCl 2 , находится под давлением 10 5 Па. Найдите парциальные давления газов в смеси.
Ответ : 50000; 14300; 35700 Па.
38. (Р.105) В закрытом сосуде объемом 6 × 10 –3 м 3 находится при 10°С смесь, состоящая из 8,8 × 10 –3 кг диоксида углерода, 3,2 × 10 –3 кг кислорода и 1,2 × 10 –3 кг метана. Вычислите общее давление газовой смеси, парциальные давления газов и их объемные доли (%).
Ответ : 147061,00; 78432,51; 39216,25; 29412,19 Па; 53,33; 26,67; 20 %.
39. (Г.69) Смешаны 4 г СН 4 и 24 г О 2 . Выразите состав газовой смеси в процентах по объему.
Ответ : 25 и 75 %.
40. (Г.70) Смешаны при нормальных условиях 56 л СН 4 и 112 л О 2 . Выразите состав газовой смеси в процентах по массе.
Ответ : 20 и 80 %.
41. (Г.71) Вычислите парциальные давления кислорода азота и кислорода в воздухе, приняв давление воздуха 101,3 кПа (воздух содержит 21 % О 2 и 78 % N 2 по объему).
Ответ : 21,3; 79 кПа.
42. (Г.72) Вычислите процентное содержание кислорода и азота в воздухе по массе. Масса 1 л воздуха (0°С и 101,3 кПа) составляет 1,293 г.
Ответ : 23,2 и 75,5 %.
43. (Г.75) Вычислите массу 70 мл кислорода, собранного над водой при 7°С и 102,3 кПа. Давление пара воды при той же температуре равно 1 кПа.
Ответ : 97,5 мг.
44. (Г.76) Какой объем займут 0,12 г кислорода, если собрать газ над водой при 14°С и 102,4 кПа. Давление пара воды при той же температуре составляет 1,6 кПа.
Ответ : 88,7 мл.
45. (Г.81) Сколько молей кислорода и азота содержится в аудитории размером 6´8´5 м при 22°С и 100,0 кПа?
Ответ : 2055 и 7635 моль.
46. (Г.83) В камеру вместимостью 1 м 3 заключили 15 моль N 2 , 25 моль СО 2 и 10 моль О 2 . Вычислите: а) общее давление смеси газов при 27°С; б) процентный состав смеси по массе; в) процентный состав смеси по объему; г) парциальное давление каждого из газов при заданной температуре.
Ответ : 125 кПа; 22,8; 59,8; 17,4 %; 30; 50 и 20 %; 37,4; 62,3; 24,9 кПа.
47. (Г.85) В каком объеме воздуха (0°С и 101,3 кПа) содержится 1 мг аргона? Воздух содержит 0,93 % аргона по объему.
Газовая смесь находится в состоянии равновесия, если концентрации компонентов и её параметры состояния во всём объёме имеют одинаковые значения. При этом температура всех газов, входящих в смесь, одинакова и равна температуре смеси Т см.
В равновесном состоянии молекулы каждого газа рассеяны равномерно по всему объёму смеси, то есть имеют свою определённую концентрацию и, следовательно, своё давление р i , Па, которое называется парциальным . Оно определяется следующим образом.
Парциальное давление равно давлению данного компонента при условии, что он один занимает весь объём, предназначенный для смеси при температуре смеси Т см .
По закону английского химика и физика Дальтона, сформулированному в 1801 году, давление смеси идеальных газов р см равно сумме парциальных давлений её компонентов р i :
где n – число компонентов.
Выражение (2) также называется законом парциальных давлений.
3.3. Приведённый объём компонента газовой смеси. Закон Амага
По определению приведённым объёмом i -го компонента газовой смеси V i , м 3 , называется объём, который один этот компонент мог бы занимать при условии, что его давление и температура будут равны давлению и температуре всей газовой смеси.
Закон французского физика Амага, сформулированный примерно в 1870 году, гласит: сумма приведённых объёмов всех компонентов смеси равна объёму смеси V см :
 ,
м 3 . (3)
,
м 3 . (3)
3.4. Химический состав газовой смеси
Химический состав газовой смеси может задаваться тремя различными способами.
Рассмотрим газовую смесь, состоящую из n компонентов. Смесь занимает объём V см, м 3 , имеет массу М см, кг, давление р см, Па и температуру Т см, К. Также число молей смеси равно N см, моль. При этом масса одного i -го компонента m i , кг, а число молей этого компонента ν i , моль.
Очевидно, что:
 , (4)
, (4)
 . (5)
. (5)
Используя для рассматриваемой смеси закон Дальтона (2) и Амага (3) можно записать:
 , (6)
, (6)
 , (7)
, (7)
где р i – парциальное давление i -го компонента, Па; V i – приведённый объём i -го компонента, м 3 .
Однозначно химический состав газовой смеси может быть задан либо массовыми, либо мольными, либо объёмными долями её компонентов:
 , (8)
, (8)
 , (9)
, (9)
 , (10)
, (10)
где g i , k i и r i – массовая, мольная и объёмная доли i -го компонента смеси соответственно (безразмерные величины).
Очевидно, что:
 ,
,
 ,
, . (11)
. (11)
Часто на практике химический состав смеси задаётся не долями i -го компонента, а его процентами.
Например, в теплотехнике приближённо принимается, что сухой воздух состоит из 79 объёмных процентов азота и 21 объёмного процента кислорода.
Процент i -го компонента в смеси вычисляется путём умножения его доли на 100.
Для примера с сухим воздухом будем иметь:
 ,
,
 . (12)
. (12)
где
 и
и
 –
объёмные доли азота и кислорода в сухом
воздухе; N 2
и О 2
– обозначение объёмных процентов азота
и кислорода соответственно, % (об.).
–
объёмные доли азота и кислорода в сухом
воздухе; N 2
и О 2
– обозначение объёмных процентов азота
и кислорода соответственно, % (об.).
Примечание:
1) Мольные доли идеальной смеси численно равны объёмным долям: k i = r i . Докажем это.
Пользуясь определением объёмной доли (10) и законом Амага (3) можем записать:
 ,
(13)
,
(13)
где
V
i
– приведённый объём
i
-го
компонента, м
3
;
ν
i
– число молей
i
-го
компонента, моль;
 –
объём одного моля
i
-го
компонента при давлении смеси р
см
и температуре
смеси Т
см ,
м
3
/моль.
–
объём одного моля
i
-го
компонента при давлении смеси р
см
и температуре
смеси Т
см ,
м
3
/моль.
Из закона Авогадро (см. п. 2.3 данного приложения) следует, что при одинаковых температуре и давлении один моль любого газа (компонента смеси) занимает один и тот же объём. В частности, при Т см и р см это будет некоторый объём V 1 , м 3 .
Сказанное позволяет записать равенство:
 .
(14)
.
(14)
Подставляя (14) в (13) получаем требуемое:
 .
(15)
.
(15)
2) Объёмные доли компонентов газовой смеси можно рассчитать, зная их парциальные давления. Покажем это.
Рассмотрим i -ый компонент идеальной газовой смеси в двух различных состояниях: когда он находится при своём парциальном давлении р i ; когда он занимает свой приведённый объём V i .
Уравнение состояния идеального газа справедливо для любых его состояний, в частности, и для двух, названных выше.
В соответствии с этим, и учитывая определение удельного объёма, можем записать:
 ,
(16)
,
(16)
 ,
(17)
,
(17)
где R i – газовая постоянная i -го компонента смеси, Дж/(кг·К).
После деления обоих частей (16) и (17) друг на друга получаем требуемое:
 .
(18)
.
(18)
Из (18) видно, что парциальные давления компонентов смеси можно рассчитать по её химическому составу, при известном общем давлении смеси р см :
 .
(19)
.
(19)
Парциа́льное давление (лат. partialis - частичный, от лат. pars - часть) - давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре. При этом пользуются также законом парциальных давлений: общее давление газовой смеси равно сумме парциальных давлений отдельных газов, составляющих данную смесь, то естьРобщ = Р1 + Р2 + .. + Рп
Из формулировки закона следует, что парциальное давление представляет собой частичное давление, создаваемое отдельным газом. И действительно, парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем.
12.Дайте определение понятиям: система, фаза, среда, макро- и микросостояние.
Системой называется совокупность находящихся во взаимодействии веществ, обособленная от окружающей среды. Различают гомогенные и гетерогенные системы.
Систему называют термодинамической , если между телами, ее составляющими, может происходить обмен теплотой, веществом и если система полностью описывается термодинамическими понятиями.
В зависимости от характера взаимодействия с окружающей средой различают системы открытые, закрытые и изолиро ванные .
Каждое состояние системы характеризуется определенным набором значений термодинамических параметров (параметров состояния, функций состояния).
13.Назовите основные термодинамические величины, характеризующие состояние системы. Рассмотрите смысл понятий "внутренняя энергия системы и энтальпия".
Осн параметрами состояния системы явл такие параметры, кот можно непосредственно измерить (температура, давление, плотность, масса и т. д.).
Параметры состояния, которые не поддаются непосредственному измерению и зависят от основных параметров, называются функциями состояния (внутренняя энергия, энтропия, энтальпия, термодинамические потенциалы).
В ходе химической реакции (переходе системы из одного состояния в другое) изменяется внутренняя энергия системы U:
U = U 2 -U 1 , где U 2 и U 1 - внутренняя энергия системы в конечном и начальном состояниях.
Значение U положительно (U> 0), если внутренняя энергия системы возрастает.
Энтальпия системы и ее изменение .
Работу А можно разделить на работу расширения A = pV (p = const)
и другие виды работ А" (полезная работа), кроме работы расширения: A = A" + pV,
где р - внешнее давление; V- изменение объема (V= V 2 - V\); V 2 - объем продуктов реакции; V 1 - объем исходных веществ.
Соответственно уравнение (2.2) при постоянном давлении запишется в виде: Q p = U + A" + pV.
Если на систему не действуют никакие другие силы, кроме постоянного давления, т. е. при протекании хим процесса единственным видом работы является работа расширения, тоА" = 0.
В этом случае уравнение (2.2) запишется так: Q p = U + pV.
Подставив U= U 2 – U 1 , получим: Q P =U 2 -U 1+ pV 2 + pV 1 =(U 2 +pV 2)-(U 1 + pV 1). Характеристическая функцияU + pV = Hназывается энтальпией системы . Это одна из термодинамических функций, характеризующих систему, находящуюся при постоянном давлении. Подставив уравнение (2.8) в (2.7), получим: Q p = H 2 -H 1 = r H.
Парциальные давления дыхательных газов
Согласно закону Дальтона парциальное давление (напряжение) каждого газа в смеси (Рr) пропорционально его доле от общего объема, т.е. его фракции (Fr) . Применяя этот закон к дыхательным газам, необходимо учитывать, что атмосферный воздух, как и альвеолярная газовая смесь, содержит не только О 2 , СО 2 , N 2 и благородные газы, но и водяной пар, имеющий некое парциальное давление (Pн 2 о). Поскольку фракции газов приводятся для сухой их смеси, в уравнении для закона Дальтона из общего давления (атмосферное давление: Р атм) следует вычесть давление водяного пара. Тогда парциальное давление газа будет определяться по формуле:
Рr = Fr (Р атм - Pн 2 о)
Если подставить в уравнение парциального давления газов значения Fr для кислорода или углекислого газа в атмосферном воздухе: 21% (0,21) и 0,03% (0,0003) и давления водяного пара (47 мм рт ст), то можно вычислить, что парциальное давление указанных газов в атмосферном воздухе над уровнем моря (Р атм = 760 мм рт ст) составит, соответственно, 150 мм рт ст (20кПа) для кислорода и 0,2 мм рт ст (0,03 кПа) для углекислого газа.
Из представленной формулы следует, что снижение барометрического давления, или уменьшение удельного содержания газа (кислорода - FrО 2) во вдыхаемом воздухе будет сопровождаться падением во вдыхаемом воздухе парциального давления этого газа (кислорода - РrО 2).
Напряжение кислорода в альвеолярной газовой смеси в стандартных условиях вентиляции зависит не только от его потребления, но и от выведения углекислого газа. Соответственно, при расчете парциального давления кислорода в альвеолярной газовой смеси (Р А О 2) вносится поправка на выведение СО 2 , образующегося в процессе метаболизма. Таким образом, расчетная формула определения Р А О 2 выглядит следующим образом:
Р А О 2 = РrО 2 - ________ ,
где РаСО 2 - парциальное давление углекислого газа в артериальной крови (40 мм рт ст);
R - дыхательный коэффициент, характеризующий отношение выделенного СО 2 к поглощенному О 2 (в отсутствии стресса и при нормальном питании = 0,8).
Подставляя значения этих показателей, находим:
Р А О 2 = 150 - ________ = 100 мм рт ст (13,3 кПа)
Парциальное давление углекислого газа в альвеолярной газовой смеси составляет 40 мм рт ст (5,3 кПа). Из приведенной формулы следует, что уменьшение PrO 2 будет сопровождаться снижением Р А О 2 .
Как известно, газообмен в легких идет в направлении градиентов парциальных давлений по обе стороны альвеолярно-капиллярной мембраны (Δ). Для кислорода этот градиент соответствует разнице между Р А О 2 и напряжением кислорода в капиллярах венозной крови (40 мм рт. ст.), поступающей в легкие. Однако, за время прохождения крови через легочные капилляры (0,3 сек) это давление быстро нарастает и уже через 0,1 сек составляет ≈ 90% от величины альвеолярного давления (Г. Тевс, 2007), а в последующие 0,2 сек напряжение кислорода в капиллярах уравнивается с альвеолярным. Поэтому вводится понятие среднего градиента давления между альвеолярной газовой смесью (100 мм рт ст) и кровью легочных капилляров (90 мм рт. ст.), который составляет 10 мм рт. ст.
Осмос
Осмос – явление селективной диффузии определенного сорта частиц через полупроницаемую перегородку. Это явление впервые описал аббат Нолле в 1748 г. Перегородки, проницаемые только для воды или другого растворителя и непроницаемые для растворенных веществ, как низкомолекулярных, так и высокомолекулярных, могут быть изготовлены из полимерных пленок (коллодия) или гелеобразных осадков, например, ферроцианида меди Cu 2 ; этот осадок образуется в порах перегородки стеклянного фильтра при погружении пористого материала сначала в раствор медного купороса (CuSO 4 x 5H 2 O), а затем желтой кровяной соли K 2 . Вещества диффундируют через такую перегородку, что является важным случаем осмоса, позволяющим измерять осмотическое дав-ление, т. е. осмотическое давление – мера стремления растворенного вещества перейти вследствие теплового движения в процессе диффузии из раствора в чистый растворитель; распределяется равномерно по всему объему растворителя, понизив первоначальную концентрацию раствора.
За счет осмотического давления сила заставляет жидкость подниматься вверх, это осмотическое давление уравновешивается гидростатическим давлением. Когда скорости диффундирующих веществ станут равны, тогда осмос прекратится.
Закономерности:
1. При постоянной температуре осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре.
В 1886 г. Я. Г. Вант-Гофф показал, что величина осмотического давления может быть выражена через состояние газа
P осн V = RT .
Закон Авогадро применим к разбавленным растворам: в равных объемах различных газов при одинаковой температуре и одинаковом осмотическом давлении содержится одинаковое число растворенных частиц. Растворы различных веществ, имеющие одинаковые молярные концентрации при одинаковой температуре, имеют одинаковое осмотическое давление. Такие растворы называются изотоническими.
Осмотическое давление не зависит от природы растворяемых веществ, а зависит от концентрации. Если объем заменить на концентрацию, получим:
Рассмотрим закон Вант-Гоффа : осмотическое давление раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора.
Все описанные законы относятся к бесконечно разбавленным растворам.
Парциальное давление – то давление, которое оказывал бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения постоянными температуры и объема.
Общее давление газовой смеси определяется законом Дальтона : общее давление смеси газов, занимающих определенных объем, равно сумме парциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он занимал объем, равный объему смеси газов.
Р = Р 1 + Р 2 + Р 3 + … + Р к ,
где Р – общее давление;
Р к – парциальное давление компонентов.